题目内容
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO固体120g,若上述气体为NO,则a可能为多少mol.( )
| A、2.50 | B、4.00 |
| C、7.50 | D、3.15 |
考点:有关混合物反应的计算
专题:计算题
分析:利用极限法解答,假设混合物全是CuS,或混合物全是Cu2S,根据n=
计算n(CuO),根据Cu元素守恒计算n(CuS)、n(Cu2S),再根据电子转移数目守恒,计算n(NO),实际气体介于二者之间.
| m |
| M |
解答:
解:若混合物全是CuS,其物质的量n(CuS)=n(CuO)=
=1.5mol,CuS中S的化合价由-2价上升到+6价,故转移电子物质的量为:1.5×(6+2)=12mol;有+5价的硝酸生成NO,化合价降低:(5-2)=3价,则生成一氧化氮的物质的量为:n(NO)=
=4mol;
若混合物全是Cu2S,其物质的量n(Cu2S)=
n(CuO)=
×1.5mol=0.75mol,Cu2S中S的化合价由-2价上升到+6价,且Cu元素的化合价由+1价上升到+2价,故转移电子物质的量:0.75×(8+1×2)=7.5mol,生成NO的物质的量为:n(NO)=
=2.5mol,
由于是CuS和Cu2S的混合物,则实际气体介于2.5mol~4mol之间,所以D正确,
故选D.
| 120g |
| 80g/mol |
| 12mol |
| 3 |
若混合物全是Cu2S,其物质的量n(Cu2S)=
| 1 |
| 2 |
| 1 |
| 2 |
| 7.5mol |
| 3 |
由于是CuS和Cu2S的混合物,则实际气体介于2.5mol~4mol之间,所以D正确,
故选D.
点评:本题考查氧化还原反应计算、混合物计算,题目难度中等,注意守恒思想与极限法的利用,明确氧化还原反应根据化合价变化计算得失电子的方法.

练习册系列答案
相关题目
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面.下列说法正确的是( )
| A、水、双氧水、水玻璃都是纯净物 |
| B、石墨和C60互称为同位素 |
| C、磷酸是强电解质 |
| D、一定条件下石墨转化为C60是化学变化 |
 25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )
25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全).则下列说法与判断合理的是( )| A、25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B、25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C、当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D、图中2a=b=6(c-b) |
环保的主题是“节能减排,和谐发展.”你认为下列行为中有悖于这一主题的是( )
| A、将煤进行气化处理,提高煤的综合利用效率[ |
| B、大量开采煤、石油,提高产量以满足工业生产的快速发展 |
| C、开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 |
| D、实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
下列实验设计和结论相符的是( )
| A、某无色溶液中加入酸性KMnO4溶液,溶液紫红色褪去,则该溶液中一定含有Fe2+ |
| B、某气体能使湿润的红色石蕊试纸变蓝,则该气体水溶液一定显碱性 |
| C、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42- |
| D、在含有FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
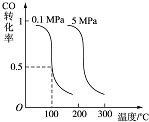 CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图:
CO可用于合成甲醇.在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)?CH3OH(g)平衡时CO的转化率与温度、压强的关系如图: