题目内容
将7g某铜银合金与足量的a mol/L的硝酸充分反应,完全溶解后放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全吸收,此合金中铜的质量是( )g.
| A、3 | B、2.4 |
| C、1.6 | D、4.8 |
考点:有关混合物反应的计算
专题:计算题
分析:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答:
解:n(O2)=
=0.025mol,
铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=7g
根据电子守恒列方程:2x+1×y=0.025mol×4
解得:x=0.025mol,y=0.05mol
m(Cu)=0.025mol×64g/mol=1.6g,
故选C.
| 0.56L |
| 22.4L/mol |
铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,
设Cu、Ag的物质的量分别为x、y,则:
根据质量列方程:x×64g/mol+y×108g/mol=7g
根据电子守恒列方程:2x+1×y=0.025mol×4
解得:x=0.025mol,y=0.05mol
m(Cu)=0.025mol×64g/mol=1.6g,
故选C.
点评:本题考查混合物计算,难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意氧化还原反应中守恒思想的运用.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、78g Na2O2与足量水充分反应时电子转移数为2NA |
| B、NA个氯气分子的体积为22.4L |
| C、4℃、101kPa时,54mL H2O中含有的分子数为3NA |
| D、2L 1mol/L Na2SO4溶液中离子总数为3NA |
下列反应达到平衡时,哪种条件下生成物的含量最高:X2(g)+2Y2 (g)?X2Y4 (g) (正反应为放热反应)( )
| A、高温 高压 |
| B、低温 低压 |
| C、高温 低压 |
| D、高压 低温 |
用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液不能与原来溶液完全一样的是( )
| A、NaCl[HCl] |
| B、AgNO3[Ag2O] |
| C、CuCl2[CuSO4] |
| D、CuSO4[CuO] |
把一块镁铝合金投入到1mol?L-1 盐酸中,待合金完全溶解后,再往溶液里加入1mol?L-1 NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示.下列说法中错误的是( )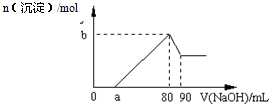

| A、盐酸的体积为80mL |
| B、a的取值范围为0<a<50 |
| C、n(Mg2+)≥0.025mol |
| D、当a值为30时,b值为0.02 |
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体a mol,向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO固体120g,若上述气体为NO,则a可能为多少mol.( )
| A、2.50 | B、4.00 |
| C、7.50 | D、3.15 |
由FeO、Fe3O4和Fe2O3组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则该混合物中FeO、Fe3O4和Fe2O3的物质的量之比可能是( )
| A、1:1:2 |
| B、2:1:1 |
| C、1:2:2 |
| D、1:1:1 |
A、B两种气态烃以1:2的体积比混合后点燃,完全燃烧生成的二氧化碳和水的物质的量之比为4:5,此两种烃可能是( )
| A、CH4和C2H4 |
| B、CH4和C2H6 |
| C、C2H2和CH4 |
| D、C2H4和C2H2 |