题目内容
14.常温下将amol•L-1的醋酸与bmol•L-1Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则混合溶液中醋酸的电离常数Ka=$\frac{2b}{a-2b}$×10-7( 含a和b的代数式表示)分析 溶液等体积混合溶质浓度减少一半,醋酸电离平衡常数与浓度无关,结合概念计算,通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K.
解答 解:通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,溶液中溶质为醋酸钡和氢氧化钡,反应平衡时,2c(Ba2+)=c(CH3COO-)=bmol/L,溶液中c(H+)=c(OH-)=10-7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出K=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{b×1{0}^{-7}}{\frac{a}{2}-b}$=$\frac{2b}{a-2b}$×10-7;
用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7;
故答案为:$\frac{2b}{a-2b}$×10-7.
点评 本题考查了弱电解质在水溶液中的电离平衡以及电离平衡常数的求算,注意根据电离平衡常数的概念计算即可,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
4.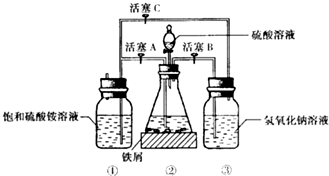 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
回答下列问题:
Ⅰ.
(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABD(填序号).
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A;,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭、打开有关活塞继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是在相同温度下,硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
 硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.
硫酸亚铁铵是一种浅蓝绿色晶体,俗称摩尔盐,其化学式为:FeSO4•(NH4)2SO4•6H2O.硫酸亚铁在空气中易被氧化,而形成摩尔盐后就稳定了.硫酸亚铁铵可由硫酸亚铁与硫酸铵等物质的量混合制得.三种盐的溶解度(单位为g/100g水)如表:下图是模拟工业制备硫酸亚铁铵晶体的实验装置.| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| 摩尔盐 | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.
(1)先用30%的氢氧化钠溶液煮沸废铁屑(含少量油污、铁锈、FeS),再用清水洗净.用氢氧化钠溶液煮沸的目的是除去铁屑中油污
(2)将处理好的铁屑放人锥形瓶中,加入稀硫酸.锥形瓶中发生反应的离子方程式可能为ABD(填序号).
A.Fe+2H+═Fe2++H2↑ B.Fe2O3+6H+═2Fe3++3H2O
C.2Fe3++S2-═2Fe2++S↓ D.2Fe3++Fe═3Fe2+
(3)利用容器②的反应,向容器①中通入氢气,应关闭活塞A;,打开活塞BC (填字母).容器③中NaOH溶液的作用是吸收硫化氢气体,防止污染空气;向容器①中通人氢气的目的是防止亚铁离子被氧气氧化.
Ⅱ.待锥形瓶中的铁屑快反应完时,关闭、打开有关活塞继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵.
硫酸亚铁与硫酸铵溶液混合就能得到硫酸亚铁铵晶体,其原因是在相同温度下,硫酸亚铁铵的溶解度最小;从容器①中分离并得到纯净硫酸亚铁铵晶体的操作方法是过滤、用酒精洗涤、干燥.
19.下列关于化学反应分类的说法中,正确的是( )
| A. | 凡是有单质生成的分解反应一定是氧化还原反应 | |
| B. | CO与Fe2O3高温下反应为氧化还原反应,是置换反应 | |
| C. | 天然气的燃烧,不属于置换反应,为非氧化还原反应 | |
| D. | 1828年德国化学家维勒最先完成有机物的制取:NH4CNO$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2,该反应不属于四种反应类型中的任何一种,但属于氧化还原反应 |
6.对于反应:H2O+NaH═NaOH+H2↑,下列判断正确的是( )
| A. | NaH被还原 | |
| B. | NaH体现氧化性 | |
| C. | H2O既不是氧化剂又不是还原剂 | |
| D. | 若生成22.4 L标准状况下的H2,则有1 mol电子转移 |
4.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40gNaOH溶于1L水所得的溶液 | |
| B. | 常温常压下,将22.4LHCl气体溶于水配成1L盐酸溶液 | |
| C. | 将23gNa溶于水并配成1L溶液 | |
| D. | 含K+为1 mol•L-1的K2SO4溶液 |


 .
. .
. 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.