题目内容
3.丹参酮ⅡA是一种治疗心血管疾病的药物,其中的一种合成路线如下: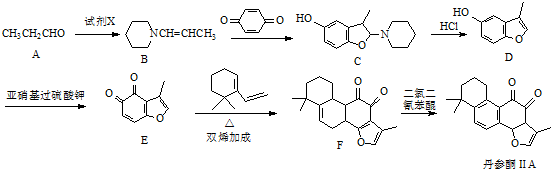
(1)丹参酮ⅡA中含氧官能团为羰基和醚键(写名称).
(2)试剂X的分子式为C5H11N,则X的结构简式为
 .
.(3)C→D的反应类型为消去反应.
(4)写出同时满足下列条件的E的一种同分异构体的结构简式:
 .
.Ⅰ.能发生银镜反应
Ⅱ.分子中除苯环外不含其它环状结构,分子中含有4种不同化学环境的氢
(5)写出以CH3CH=CHCH3和CH2=CHCHO为原料制备
 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:CH3CHO$→_{催化剂,△}^{O_{2}}$CH3COOH$→_{浓H_{2}SO_{4},△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
分析 (1)根据丹参酮ⅡA的结构简式可知所含有的官能团;
(2)X的分子式为C5H11N,A与X生成B,根据B的结构简式可知X为  ,据此答题;
,据此答题;
(3)比较C和D的结构简式可知,C分子中脱去一分子X形成碳碳双键得D,据此答题;
(4)根据条件Ⅰ.能发生银镜反应,说明有醛基,Ⅱ.分子中除苯环外不含其它环状结构,分子中含有4种不同化学环境的氢,结合E的结构简式可写出E的同分异构体;
(5)以CH3CH=CHCH3和CH2=CHCHO为原料制备 ,可以先用CH3CH=CHCH3与溴发生加成反应得CH3CHBrCHBrCH3,CH3CHBrCHBrCH3在氢氧化钠的醇溶液中发生消去反应得CH2=CHCH=CH2,CH2=CHCH=CH2再与CH2=CHCHO发生加成反应形成环,再与氢气发生加成反应得
,可以先用CH3CH=CHCH3与溴发生加成反应得CH3CHBrCHBrCH3,CH3CHBrCHBrCH3在氢氧化钠的醇溶液中发生消去反应得CH2=CHCH=CH2,CH2=CHCH=CH2再与CH2=CHCHO发生加成反应形成环,再与氢气发生加成反应得 .
.
解答 解:(1)根据丹参酮ⅡA的结构简式可知所含有的官能团为羰基、醚键,
故答案为:羰基、醚键;
(2)X的分子式为C5H11N,A与X生成B,根据B的结构简式可知X为  ,
,
故答案为: ;
;
(3)比较C和D的结构简式可知,C分子中脱去一分子X形成碳碳双键得D,所以该反应类型为消去反应,
故答案为:消去反应;
(4)根据条件Ⅰ.能发生银镜反应,说明有醛基,Ⅱ.分子中除苯环外不含其它环状结构,分子中含有4种不同化学环境的氢,结合E的结构简式可知,符合条件的E的同分异构体为 ,
,
故答案为: ;
;
(5)以CH3CH=CHCH3和CH2=CHCHO为原料制备 ,可以先用CH3CH=CHCH3与溴发生加成反应得CH3CHBrCHBrCH3,CH3CHBrCHBrCH3在氢氧化钠的醇溶液中发生消去反应得CH2=CHCH=CH2,CH2=CHCH=CH2再与CH2=CHCHO发生加成反应形成环,再与氢气发生加成反应得
,可以先用CH3CH=CHCH3与溴发生加成反应得CH3CHBrCHBrCH3,CH3CHBrCHBrCH3在氢氧化钠的醇溶液中发生消去反应得CH2=CHCH=CH2,CH2=CHCH=CH2再与CH2=CHCHO发生加成反应形成环,再与氢气发生加成反应得 ,合成路线为
,合成路线为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,题目难度较大,答题时注意官能团之间原转化,易错点为(4)以及同分异构体的判断,注意把握,难点为(5)有机合成路线的设计,注意合理利用题中信息.

| A. | 降低温度,正反应速率减小、逆反应速率增大 | |
| B. | 增大c(A)、c(B),K增大 | |
| C. | 该反应的化学方程式为2E(g)+F(s)?A(g)+2B(g) | |
| D. | 该反应的焓变△H>0 |
| A. | 该反应中氮元素被氧化 | |
| B. | 该反应中H2O2作还原剂 | |
| C. | 实验室配制NaCN溶液时,需加入适量的NaOH溶液 | |
| D. | 0.1mol•L-1NaCN溶液中含HCN和CN-总数目为0.1×6.02×1023 |
| A. | 钢铁在Cl2气氛中主要发生电化腐蚀 | |
| B. | 在新制氯水中加入少量CaCO3,溶液中c(HClO)增大 | |
| C. | 反应3Cl2(g)+8NH3(g)=6NH4Cl(s)+N2(g)的△H>0,△S<0 | |
| D. | 0.1mol•L-1NaClO溶液中:c(HClO)+c(H+)=c(OH-) |
 黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )
黄曲霉毒素M1是一种具有强致癌性的有机物,其分子结构如图所示.下列有关黄曲霉毒素M1的说法正确的是( )| A. | 黄曲霉毒素M1的分子式为C17H14O7 | |
| B. | 黄曲霉毒素M1含有羟基,此羟基能被催化氧化为醛基 | |
| C. | 1mol黄曲霉毒素M1与NaOH溶液发生反应最多能消耗2molNaOH | |
| D. | 1mol黄曲霉毒素M1最多能与7molH2发生加成反应 |
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)
△H=-185kJ•mol-1

请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 432 |
③图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定
a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)
△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)
△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.
