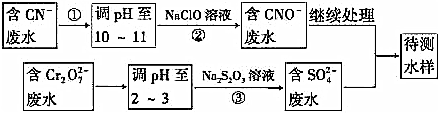
题目内容
7.下列化学用语表示正确的是( )| A. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| B. | 三氟化氮的电子式: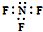 | |
| C. | 熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)═Na++HSO4- | |
| D. | 硫化钠溶液显碱性的原因:S2-+H2O?H2S+2OH- |
分析 A.NaH与重水反应实质是离子反应,氢负离子与水电离的氢离子结合生成氢气;
B.氟原子未成键的孤对电子对为画出;
C.硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成;
D.硫离子的水解分步进行,主要以第一步为主,水解方程式写出第一步的方程式即可.
解答 解;A.NaH与重水反应实质是离子反应,氢负离子与水电离的氢离子结合生成氢气,NaH与重水反应的方程式为:NaH+D2O=NaOD+HD↑,故A错误;
B.氟原子未成键的孤对电子对为画出,其正确的电子式为 ,故B错误;
,故B错误;
C.硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成,熔融下电离出钠离子与硫酸氢根离子,电离方程式:NaHSO4(熔融)=Na++HSO4-,故C正确;
D.氯化钠溶液中硫离子的水解主要以第一步为主,正确的水解方程式为:S2-+H2O?HS-+OH-,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、电离方程式、化学方程式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
相关题目
17.相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应.二者比较,相等的是( )
| A. | 铜片消耗完所需时间 | B. | 反应生成的气体体积(标准状况下) | ||
| C. | 反应中氧化剂得到的电子总数 | D. | 反应后溶液中硝酸银离子的浓度 |
15.下列溶液中各微粒的浓度关系正确的是( )
| A. | 室温下,pH>7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:c(Na+)=c(Cl-) | |
| C. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| D. | 0.2mol•L-1某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
12. 为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )
为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )
 为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )
为验证铜与稀硝酸反应的还原产物是NO而不是NO2.某同学设计了如图所示的装置,下列叙述错误的是( )| A. | 应先打开活塞和旋塞再从U型管右侧加入稀硝酸 | |
| B. | 加入的稀硝酸应充满U型管左侧 | |
| C. | 关闭旋塞后铜丝会全部溶解 | |
| D. | 反应停止后打开活塞,气体变成红棕色 |
19.下列说法不正确的是( )
| A. | HNO3、NaOH、BaSO4均属于电解质 | |
| B. | SO2、NO2、CO2均能形成酸雨 | |
| C. | NH4HCO3、NH4Cl、I2受热后均无固体剩余 | |
| D. | FeCl2、NaHSO3、Fe(OH)3均能通过化合反应直接制得 |
7.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3、NaCl中的一种或几种组成.将该粉末与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温、同压下测定).若将该粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量.下列判断正确的是( )
| A. | 粉末中一定有Na2O、Na202、NaHC03 | |
| B. | 粉末中一定不含有Na2C03和NaCl | |
| C. | 粉末中一定不含有Na20和NaCl | |
| D. | 无法肯定粉末里是否含有NaHCO3和NaC1 |

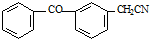 由C→D的反应类型是取代反应
由C→D的反应类型是取代反应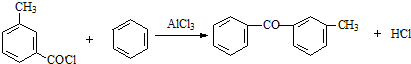

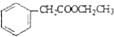 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH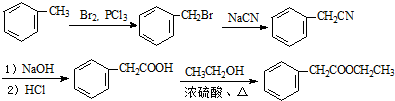 .
.