题目内容
15.一种微生物燃料电池如图所示,下列关于该电池的说法正确的是( )
| A. | b电极反应式为2NO3-+10e-+12H+=N2↑+6H2O | |
| B. | a电极发生还原反应 | |
| C. | H+由右室通过质子交换膜进入左室 | |
| D. | 电池工作时,电流由a电极沿导线流向b电极 |
分析 A、b极上N元素的化合价降低,所以b是正极发生还原反应;
B、b极上N元素的化合价降低,所以b是正极发生还原反应,a是负极,发生氧化反应;
C、原电池中阳离子从负极移向正极;
D、原电池中电流从正极流向负极,据此回答.
解答 解:A、b极上N元素的化合价降低,b是正极,发生还原反应,电极反应式为:2NO3-+10e-+12H+═N2↑+6H2O,故A正确;
B、b极上N元素的化合价降低,所以b是正极发生还原反应,故B错误;
C、原电池中阳离子从负极移向正极,即H+由左室通过质子交换膜进入右室,故C错误;
D、原电池中电流从正极流向负极,电流由B电极沿导线流向A电极,故D错误.
故选A.
点评 本题考查化学电源新型电池,为高频考点,所有燃料电池中负极上都是燃料失电子、正极上都是氧化剂得电子,难点是电极反应式的书写,要结合电解质溶液酸碱性书写,为学习难点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.设NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| B. | 28克由C3H6和C4H8组成的混合气体中含共用电子对数目为6NA个 | |
| C. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| D. | 常温下,0.1mol•L-1的碳酸钠溶液中含有的阴离子数大于0.1NA |
10. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(NH3)4】2+具有对称的空间构型.且当【E(NH3)4】2+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则【E(NH3)4】2+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式${N_A}=\frac{{\sqrt{2}×{{10}^{30}}M}}{{8{r^3}ρ}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多的 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(NH3)4】2+具有对称的空间构型.且当【E(NH3)4】2+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则【E(NH3)4】2+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式${N_A}=\frac{{\sqrt{2}×{{10}^{30}}M}}{{8{r^3}ρ}}$.(用M、r、ρ表示)
7.按下述实验方法制备气体,合理又实用的是( )
| A. | 锌粒与稀 HNO3反应制备 H2 | B. | 加热分解 NH4Cl 固体制 NH3 | ||
| C. | 大理石与稀 H2SO4反应制备 CO2 | D. | 亚硫酸钠与浓 H2SO4反应制备 SO2 |
 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):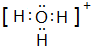 .
. 
 .
.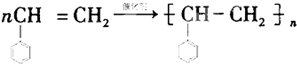 .
.