题目内容
20.如图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法正确的是( )
| A. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% | |
| B. | 该硫酸试剂的物质的量浓度为18.4mol/L | |
| C. | 50mL该H2SO4中加入足量的铜片加热,被还原的H2SO4的物质的量为0.46mol | |
| D. | 2.7gAl与足量的该硫酸反应可得到标准状况下的H23.36L |
分析 A.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,据此判断;
B.根据c=$\frac{1000ρw}{M}$计算浓硫酸的物质的量浓度;
C.Cu与浓硫酸反应,与稀硫酸不反应,结合方程式计算判断;
D.Al遇到浓硫酸发生钝化.
解答 解:A.浓硫酸的密度大于水的密度,等体积混合后溶液质量小于浓硫酸的2倍,而混合后溶质硫酸的质量不变,所以该硫酸与等体积的水混合所得溶液的质量分数大于49%,故A错误;
B.该浓硫酸的物质的量浓度为$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,故B正确;
C.随反应的进行,浓硫酸变为稀硫酸,Cu与稀硫酸不反应,根据Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,可知生成二氧化硫小于0.05L×18.4mol/L×$\frac{1}{2}$=0.46mol,故C错误;
D.Al遇到浓硫酸发生钝化,故D错误;
故选B.
点评 本题考查溶液浓度有关计算,涉及物质的量浓度、质量分数计算、浓硫酸的性质等,难度不大,注意理解掌握物质的量浓度与质量分数之间关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.酸雨、臭氧层被破坏、温室效应和土地荒漠化是当今人类面临的严重环境问题.下列说法中错误的是( )
| A. | 在冰箱中使用含氟致冷剂,会破坏臭氧层 | |
| B. | 大量使用矿物燃料会导致温室效应 | |
| C. | 大量含硫燃料的燃烧会导致酸雨的增多 | |
| D. | 气侯变暖是导致土地荒漠化的主要原因 |
8.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 23gNO2和23gN2O4所含原子数目均为1.5NA | |
| B. | 5.6 g铁与足量盐酸反应转移的电子数为0.3NA | |
| C. | 在常温常压下11.2L氯气所含的原子数目为NA | |
| D. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
15.15g SiO2和足量的碳在高温下发生反应:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,下列叙述正确的是( )
| A. | 氧化剂和还原剂的质量比1:2 | B. | SiO2是还原剂 | ||
| C. | 反应中有6g碳被氧化 | D. | 反应中生成28gCO |
5.下列有关硅的叙述中,正确的是( )
| A. | 硅的化学性质不活泼,在自然界中可以以游离态存在 | |
| B. | 硅是构成矿石和岩石的主要元素,硅在地壳中的含量在所有元素中居第二位 | |
| C. | 单晶硅常用于制造光导纤维 | |
| D. | 可用石英坩埚加热NaOH |
12.在无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、MnO4-、Mg2+、SO42- | B. | K+、Na+、Cl-、CO32- | ||
| C. | Zn2+、Al3+、NO3-、Cl- | D. | Na+、Fe2+、NO3-、SO42- |
9.下列物质既属于铵盐,又属于硫酸盐的是( )
| A. | NH4Cl | B. | (NH4)2S | C. | (NH4)2SO4 | D. | CuSO4 |
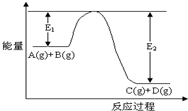 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题