题目内容
(1)金属铜与稀硫酸、稀盐酸不反应,向溶液中加入 溶液时,铜也会溶解.
A.NaOH B.浓盐酸 C.KNO3 D.NaCl
(2)铜可以与浓硫酸、浓硝酸和稀硝酸反应,这是因为浓硫酸、浓硝酸和稀硝酸都具有 性.
(3)铜与浓硫酸反应需要加热,反应方程式为: ;
(4)铜与足量浓硝酸反应生成的气体是 (填化学式),该气体的颜色为 色.
A.NaOH B.浓盐酸 C.KNO3 D.NaCl
(2)铜可以与浓硫酸、浓硝酸和稀硝酸反应,这是因为浓硫酸、浓硝酸和稀硝酸都具有
(3)铜与浓硫酸反应需要加热,反应方程式为:
(4)铜与足量浓硝酸反应生成的气体是
考点:浓硫酸的性质,硝酸的化学性质,铜金属及其重要化合物的主要性质
专题:元素及其化合物
分析:浓硫酸具有吸水性,可用作干燥剂,具有脱水性,可使蔗糖脱水碳化,浓硫酸和浓硝酸都具有强氧化性,可使铝、铁在常温下钝化,且硝酸易挥发,以此解答该题.
解答:
解:(1)酸性条件下,铜可与硝酸根离子发生氧化还原反应,则可加硝酸钾溶解铜,故答案为:C;
(2)浓硫酸、浓硝酸和稀硝酸都具有强氧化性,可与铜反应,故答案为:(强)氧化性;
(3)铜与浓硫酸在加热条件下发生氧化还原反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(4)铜与足量浓硝酸反应生成的气体是NO2,为红棕色气体,故答案为:NO2;红棕.
(2)浓硫酸、浓硝酸和稀硝酸都具有强氧化性,可与铜反应,故答案为:(强)氧化性;
(3)铜与浓硫酸在加热条件下发生氧化还原反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(4)铜与足量浓硝酸反应生成的气体是NO2,为红棕色气体,故答案为:NO2;红棕.
点评:本题综合考查浓硫酸、浓硝酸的性质,为高考常见题型和高频考点,注意浓硫酸的特性,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
过量的铁粉与100mL 0.1mol/L的稀盐酸反应,反应速率太快.为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓盐酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 1mol/L的盐酸.
①加H2O ②加NaOH固体 ③滴入过量浓盐酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10mL 1mol/L的盐酸.
| A、①⑥⑦ | B、①④⑤ |
| C、③⑦⑧ | D、③⑥⑦⑧ |
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中二价铁离子和三价铁离子的浓度恰好相等,则已反应的三价铁和未反应的三价铁的物质的量之比为( )
| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
下列关于明矾净水的说法中不正确的是( )
| A、明矾溶于水后,铝离子发生水解,生成氢氧化铝胶体 |
| B、氢氧化铝胶体因吸附溶液中的阳离子而带正电荷 |
| C、带正电荷的氢氧化铝胶粒能吸附水中杂质,并使这些杂质与氢氧化铝胶体一起凝聚而沉降 |
| D、天然水经明矾处理后可除去水中的杂质和细菌,就可以饮用了 |
将-CH3、-OH、-COOH、-CHO、- 五种原子团两两结合,所得有机化合物水溶液呈酸性的共( )
五种原子团两两结合,所得有机化合物水溶液呈酸性的共( )
 五种原子团两两结合,所得有机化合物水溶液呈酸性的共( )
五种原子团两两结合,所得有机化合物水溶液呈酸性的共( )| A、3种 | B、4种 | C、5种 | D、6种 |
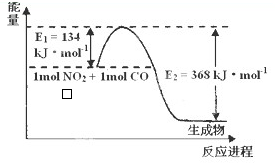 (1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下:
(1)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下: 将洁净的铁片和其他金属片A、B、C、D分别放在浸有NaCl溶液的滤纸上并压紧(如图所示).在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的铁片和其他金属片A、B、C、D分别放在浸有NaCl溶液的滤纸上并压紧(如图所示).在每次实验时,记录电压表指针的移动方向和电压表的读数如下: