题目内容
18.对C、N、O元素的有关比较表述不正确的是( )| A. | 氢化物稳定性:CH4<NH3<H2O | B. | 第一电离能:C<N<O | ||
| C. | 电负性:C<N<O | D. | 氢化物沸点:CH4<NH3<H2O |
分析 A.非金属性越强,对应氢化物越稳定;
B.非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构;
C.非金属性越强,电负性越大;
D.NH3、H2O均含氢键沸点高,且水中氢键多.
解答 解:A.非金属性C<N<O,对应氢化物稳定性:CH4<NH3<H2O,故A正确;
B.非金属性越强,第一电离能越大,且N的2p电子半满为稳定结构,则第一电离能:C<O<N,故B错误;
C.非金属性C<N<O,则电负性为C<N<O,故C正确;
D.NH3、H2O均含氢键沸点高,且水中氢键多,则氢化物沸点:CH4<NH3<H2O,故D正确;
故选B.
点评 本题考查元素周期律和周期表的应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
8.下列金属单质,活泼性最强的是( )
| A. | Na | B. | Mg | C. | Al | D. | Fe |
9.括号内物质为杂质,下列除去杂质的方法不正确的是( )
| A. | 乙酸乙酯(乙酸):用NaOH溶液洗涤后分液 | |
| B. | 乙烷(乙烯):用溴水洗气 | |
| C. | 溴苯(溴):用NaOH溶液洗涤后分液 | |
| D. | 乙醇(水):用生石灰吸水后蒸馏 |
13.下列物质的性质比较,正确的是( )
| A. | 酸性:H2SO4>HClO4 | B. | 碱性:NaOH>KOH | ||
| C. | 非金属性:P>S>Cl | D. | 气态氢化物稳定性:HF>HCl>H2S |
3.能产生“丁达尔效应”的是( )
| A. | 泥水 | B. | 淀粉溶液 | C. | 氯化铁溶液 | D. | 稀硫酸 |
10.关于如图所示装置的叙述,正确的是( )
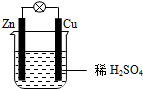

| A. | Cu为负极,Zn为正极 | B. | 电子从铜片经外电路流向锌片 | ||
| C. | 负极反应为:Zn-2e-═Zn2+ | D. | 该装置将电能转化为化学能 |
7.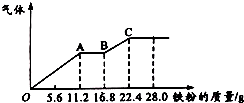 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A. | 混合酸中H2SO4浓度为4 mol•L-1 | |
| B. | 200mL混合酸中NO3-物质的量为0.2mol | |
| C. | AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 | |
| D. | 加入铜粉的那份混合酸,反应后剩余0.1mol H2SO4 |
8.下列有关化学键的叙述,正确的是( )
| A. | 离子化合物中一定只含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 仅含有共价键的化合物一定是共价化合物 | |
| D. | 由不同种非金属元素的原子形成的共价化合物一定只含极性键 |
