题目内容
18.某种铁的氧化物14.5g,用足量的一氧化碳还原,将生成的气体通入足量的澄清石灰水中,得到干燥的沉淀25g,通过计算写出该铁的氧化物的化学式.分析 假设铁的氧化物的化学式为FexOy,则它与一氧化碳反应的方程式为:FexOy+yCO$\frac{\underline{\;高温\;}}{\;}$xFe+yCO2,Ca(OH)2+CO2═CaCO3↓+H2O,依据铁的氧化物与一氧化碳以及二氧化碳和氢氧化钙反应的方程式推算铁的氧化物的化学式进而对相关选项作出判断.
解答 解:设铁的氧化物的化学式是:FexOy
由方程式:FexOy+yCO $\frac{\underline{\;高温\;}}{\;}$xFe+yCO2
CO2+Ca(OH)2=CaCO3↓+H2O
得出:
FexOy~yCO2~yCaCO3
56x+16y 100y
14.5g 25g
$\frac{56x+16y}{14.5g}=\frac{100y}{25g}$
解得:$\frac{x}{y}$=$\frac{3}{4}$,
则该物质为Fe3O4或FeO、Fe2O3或Fe2O3、Fe3O4、FeO.
答:该物质为Fe3O4或FeO、Fe2O3或Fe2O3、Fe3O4、FeO.
点评 在解此类题时,首先分析题中的反应关系,然后根据题中的数据列出比例关系进行解答.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
15.95℃时水的离子积约为KW=1.0×10-12,pH=8的CH3COONa溶液中,由水电离出的OH-浓度是( )
| A. | 1×10-10mol•L-1 | B. | 1×10-8mol•L-1 | C. | 1×10-4mol•L-1 | D. | 1×10-6mol•L-1 |
9.食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )

下列叙述错误的是( )
| A. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)中由苯酚生成苯氧乙酸的反应属于取代反应 | |
| D. | 可用溴水检验步骤(2)的产物中是否有烯丙醇(CH2=CHCH2OH) 残留 |
6.下列说法正确的是( )
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 全降解塑料(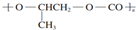 )可由单体环氧丙烷( )可由单体环氧丙烷(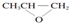 )和CO2加聚制得 )和CO2加聚制得 | |
| C. | 1mol乙酰水杨酸(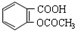 )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
13.卤素是最活泼的一族非金属元素,下列关于卤素(用X表示)的叙述正确的是( )
| A. | 单质均能与水反应生成HXO | |
| B. | 从上到下,HX的氧化性增强,对应水溶液酸性增强 | |
| C. | 从上到下,卤素原子的电子层数依次增多,原子半径依次增大 | |
| D. | 卤素均能形成最高价含氧酸,其分子通式为HXO4 |
10.将10mL0.1mol/L的氨水与10mL0.1mol/L的盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是( )
| A. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(H+)>c(OH-)>c(Cl-)>c(NH4+) | D. | c(H+)>c(Cl-)>c(NH4+)>c(OH-) |
7.反应A+B═2C,在反应过程中,断裂1mol A中的化学键消耗的能量为Q1kJ,断裂1mol B中的化学键消耗的能量为Q2kJ,形成1mol C中的化学键释放的能量为Q3kJ;1mol A所含化学能为E1kJ,1mol B所含化学能E2kJ,1molC 所含化学能E3kJ.下列说法中一定正确的是( )
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2<2Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为放热反应 | D. | 若E1+E2>E3,则反应为吸热反应 |
 )的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?
)的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?