题目内容
A、B都是芳香族化合物,1mol A水解得到1mol B和1mol醋酸.A、B的分子量都不超过200,完全燃烧都只生成CO2和H2O.且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652).A溶液具有酸性,不能使FeCl3溶液显色.
(1)A、B分子量之差为 .
(2)1个B分子中应该有 个氧原子.
(3)A的分子式是 .
(1)A、B分子量之差为
(2)1个B分子中应该有
(3)A的分子式是
考点:有机物的推断
专题:有机物的化学性质及推断
分析:A、B都是芳香族化合物,1mol A水解得到1mol B和1mol醋酸,A溶液具有酸性,不能使FeCl3溶液显色,故A中含苯环、羧基、酯基,则B分子中含有-COOH、-OH与苯环,根据B+CH3COOH→A+H2O,可知Mr(A)-Mr(B)=42,假设A的相对分子质量为200,则B的最大相对分子质量为158,含氧为1-65.2%=34.8%,则氧原子个数最大为
≈3,故B分子中含有3个O原子,其相对分子质量为
=138,一个-C6H4-、-OH、-COOH的总式量为138,故B为羟基苯甲酸,存在邻、间、对三种同分异构体,三种可能的结构简式为 、
、 、
、 ,则A的结构可能为
,则A的结构可能为 (有邻、间、对三种可能),则A的分子式为C9H8O4,以此解答该题.
(有邻、间、对三种可能),则A的分子式为C9H8O4,以此解答该题.
| 158×34.8% |
| 16 |
| 3×16 |
| 34.8% |
 、
、 、
、 ,则A的结构可能为
,则A的结构可能为 (有邻、间、对三种可能),则A的分子式为C9H8O4,以此解答该题.
(有邻、间、对三种可能),则A的分子式为C9H8O4,以此解答该题.解答:
解:(1)因“1molA水解得到1molB和1mol醋酸”可表示为“A+H2O→B+CH3COOH”,根据质量守恒知:Mr(A)+18=Mr(B)+60,得Mr(A)-Mr(B)=42,故答案为:42;
(2)A、B都是芳香族化合物,A溶液具有酸性,不能使FeCl3溶液显色,故A中含苯环、羧基、酯基,则B分子中含有-COOH、-OH与苯环,假设A的相对分子质量为200,则B的最大相对分子质量为158,含氧为1-65.2%=34.8%,则氧原子个数最大为
≈3,故B分子中含有3个O原子,故答案为:3;
(3)B的相对分子质量为
=138,一个-C6H4-、-OH、-COOH的总式量为138,故B为羟基苯甲酸,存在邻、间、对三种同分异构体,三种可能的结构简式为 、
、 、
、 ,则A的结构可能为
,则A的结构可能为 (有邻、间、对三种可能),则A的分子式为C9H8O4,故答案为:C9H8O4.
(有邻、间、对三种可能),则A的分子式为C9H8O4,故答案为:C9H8O4.
(2)A、B都是芳香族化合物,A溶液具有酸性,不能使FeCl3溶液显色,故A中含苯环、羧基、酯基,则B分子中含有-COOH、-OH与苯环,假设A的相对分子质量为200,则B的最大相对分子质量为158,含氧为1-65.2%=34.8%,则氧原子个数最大为
| 158×34.8% |
| 16 |
(3)B的相对分子质量为
| 3×16 |
| 34.8% |
 、
、 、
、 ,则A的结构可能为
,则A的结构可能为 (有邻、间、对三种可能),则A的分子式为C9H8O4,故答案为:C9H8O4.
(有邻、间、对三种可能),则A的分子式为C9H8O4,故答案为:C9H8O4.
点评:本题考查有机物的推断,注意根据性质判断可能含有的官能团,结合相对分子质量、B中氧元素含量确定B分子装置氧原子数目是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
120℃时,1L某气态烃在9L氧气中充分燃烧反应后的混合气体体积仍为10L(相同条件下),则该烃可能是( )
| A、CH4 |
| B、C2H6 |
| C、C2H2 |
| D、C6H6 |
 2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele).有一种有机物的键线式也酷似牛形(如图所示),故称为牛式二烯炔醇(cowenyenynol).下列有关说法正确的是( )
2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele).有一种有机物的键线式也酷似牛形(如图所示),故称为牛式二烯炔醇(cowenyenynol).下列有关说法正确的是( )| A、该有机物的化学式为:C29H44O |
| B、牛式二烯炔醇含有5个手性碳原子 |
| C、1mol牛式二烯炔醇最多可与4molBr2发生加成反应 |
| D、牛式二烯炔醇分子内能发生消去反应 |
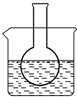 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验: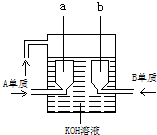 A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.
A、B、C、D4种短周期元素的原子序数依次增大,其中A、C及B、D分别是同主族元素,又知两元素的质子数之和B、D是A、C的2倍,这4种元素的单质中有2种是气体,2种是固体.