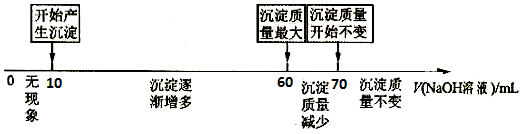
题目内容
9.把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁.则原混合溶液中钾离子的浓度为( )| A. | $\frac{a-b}{V}$ mol•L-1 | B. | $\frac{2a-b}{V}$ mol•L-1 | C. | $\frac{2(a-b)}{V}$ mol•L-1 | D. | $\frac{2(2a-b)}{V}$ mol•L-1 |
分析 两等份溶液中一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+),另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=0.5n(OH-),再利用电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),据此计算每份中n(K+),根据c=$\frac{n}{V}$计算钾离子浓度.
解答 解:混合溶液分成两等份,每份溶液浓度与原溶液浓度相同,
一份加BaCl2的溶液发生Ba2++SO42-═BaSO4↓,由方程式可知n(SO42-)=n(Ba2+)=n(BaCl2)=amol,
另一份加氢氧化钠溶液时发生Mg2++2OH-═Mg(OH)2↓,由方程式可知每份溶液中n(Mg2+)=0.5n(OH-)=0.5bmol,
由电荷守恒可知每份中2n(Mg2+)+n(K+)=2n(SO42-),故每份中溶液n(K+)=2a-2×0.5bmol=(2a-b)mol,
则原混合溶液中钾离子的浓度为$\frac{\frac{2a-b}{V}}{2}$=$\frac{2(2a-b)}{V}$mol/L,故选D.
点评 本题考查离子反应的有关计算,为高频考点,根据电荷守恒计算钾离子的物质的量是关键,侧重分析与计算能力的考查,题目难度中等.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
5.化学与环境密切相关,下列说法错误的是( )
| A. | 酸雨是指pH<5.6的雨水 | |
| B. | 二氧化碳大量排放会造成温室效应 | |
| C. | 白色污染会造成“水华”和“赤潮” | |
| D. | 燃煤中掺入生石灰能有效减少SO2的排放 |
6.用下列实验装置进行相应实验,能达到实验目的是( )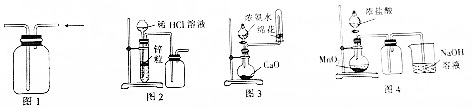

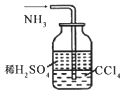
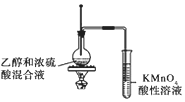
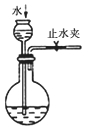
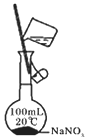
| A. | 用图1所示装置收集CO和NO | B. | 用图2所示装置制取少量氢气 | ||
| C. | 用图3所示装置制取少量氨气 | D. | 用图4所示装置制取少量氯气 |
17. 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A. | 绿原酸的分子式为C16H8O9 | |
| B. | 1mol绿原酸最多与7mol NaOH反应 | |
| C. | 绿原酸是芳香族化合物 | |
| D. | 绿原酸分子中有4种化学环境不同的氢原子 |
4.下列金属中,既能与酸反应又能与碱反应的是( )
| A. | 铁 | B. | 铜 | C. | 镁 | D. | 铝 |
14.下列说法不正确的是( )
| A. | 裂化汽油可以用于萃取溴水中的溴 | |
| B. | 甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 盛放过苯酚的试剂瓶中残留的苯酚用酒精洗涤 | |
| D. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
18.某微粒的核外L层电子的数目为8个,M层8个,该微粒一定是( )
| A. | 原子 | B. | 阴离子 | C. | 阳离子 | D. | 无法确定 |