题目内容
(1)向稀的AlCl3溶液中,逐滴加入过量的氢氧化钠溶液,边加边振荡,该反应过程中能够观察到的实验现象为 ;根据上述提示,该反应总的离子方程式可表示为 .
(2)已知Al3++3AlO2-+6H2O=4Al(OH)3↓.将氢氧化钠溶液滴入氯化铝溶液(I),或者将氯化铝溶液滴入氢氧化钠溶液(Ⅱ)中会出现不同的反应现象.现将不同的现象用不同的图象表示如下,则(I)的图象为 ,(Ⅱ) 的图象为 .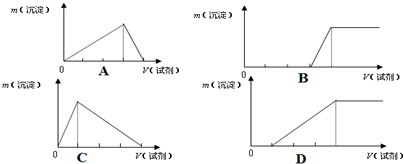
(3)除上题外还有两种溶液相互滴加顺序不同现象不同的例子,如:在饱和碳酸钠溶液中,逐滴加入稀盐酸,边加边振荡,发现最初无气体产生,但溶液变浑浊,原因是 ,离子方程式为 ,继续滴加稀盐酸有气体放出,溶液变澄清.而在稀盐酸中,逐滴加入饱和碳酸钠溶液,立即有气体产生,离子方程式为 .
(2)已知Al3++3AlO2-+6H2O=4Al(OH)3↓.将氢氧化钠溶液滴入氯化铝溶液(I),或者将氯化铝溶液滴入氢氧化钠溶液(Ⅱ)中会出现不同的反应现象.现将不同的现象用不同的图象表示如下,则(I)的图象为

(3)除上题外还有两种溶液相互滴加顺序不同现象不同的例子,如:在饱和碳酸钠溶液中,逐滴加入稀盐酸,边加边振荡,发现最初无气体产生,但溶液变浑浊,原因是
考点:镁、铝的重要化合物,钠的重要化合物
专题:图示题
分析:(1)向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,根据物质的溶解性分析解答;
(2)将氢氧化钠溶液滴入氯化铝溶液,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,看到的现象是:先产生白色沉淀,最后沉淀溶解,根据消耗的氢氧化钠的量,产生沉淀和溶解沉淀的比为3:1;则A符合;将氯化铝溶液滴入氢氧化钠溶液,发生的反应方程式为:Al3++4OH-=AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓;看到的现象是:先无沉淀,最后生成沉淀,根据消耗的氯化铝的量,无沉淀和生成沉淀的比为3:1;则B符合;
(3)因为在饱和碳酸钠溶液中,逐滴加入稀盐酸,碳酸根首先与氢离子反应生成碳酸氢根离子,使碳酸钠转化成了碳酸氢钠,因后者溶解度小于前者,所以有沉淀析出,无气泡产生;在稀盐酸中,逐滴加入饱和碳酸钠溶液,立即有气体产生,因为氢离子过量,碳酸根直接与氢离子反应生成二氧化碳和水.
(2)将氢氧化钠溶液滴入氯化铝溶液,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,看到的现象是:先产生白色沉淀,最后沉淀溶解,根据消耗的氢氧化钠的量,产生沉淀和溶解沉淀的比为3:1;则A符合;将氯化铝溶液滴入氢氧化钠溶液,发生的反应方程式为:Al3++4OH-=AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓;看到的现象是:先无沉淀,最后生成沉淀,根据消耗的氯化铝的量,无沉淀和生成沉淀的比为3:1;则B符合;
(3)因为在饱和碳酸钠溶液中,逐滴加入稀盐酸,碳酸根首先与氢离子反应生成碳酸氢根离子,使碳酸钠转化成了碳酸氢钠,因后者溶解度小于前者,所以有沉淀析出,无气泡产生;在稀盐酸中,逐滴加入饱和碳酸钠溶液,立即有气体产生,因为氢离子过量,碳酸根直接与氢离子反应生成二氧化碳和水.
解答:
解:(1)向氯化铝溶液中逐滴加入氢氧化钠溶液至过量,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,氢氧化铝是难溶性白色物质,偏铝酸钠是可溶性物质,所以看到的现象是:先产生白色沉淀,最后沉淀溶解,总反应为:Al3++4OH-=AlO2-+2H2O;
故答案为:先生成白色沉淀,然后沉淀逐渐溶解最后完全消失;Al3++4OH-=AlO2-+2H2O;
(2)将氢氧化钠溶液滴入氯化铝溶液,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,看到的现象是:先产生白色沉淀,最后沉淀溶解,根据消耗的氢氧化钠的量,产生沉淀和溶解沉淀的比为3:1;则A符合;将氯化铝溶液滴入氢氧化钠溶液,发生的反应方程式为:Al3++4OH-=AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓;看到的现象是:先无沉淀,最后生成沉淀,根据消耗的氯化铝的量,无沉淀和生成沉淀的比为3:1;则B符合,
故答案为:A;B;
(3)因为在饱和碳酸钠溶液中,逐滴加入稀盐酸,碳酸根首先与氢离子反应生成碳酸氢根离子,使碳酸钠转化成了碳酸氢钠,因后者溶解度小于前者,所以有沉淀析出,无气泡产生,反应离子方程式为:Na++H++CO32-=NaHCO3↓;在稀盐酸中,逐滴加入饱和碳酸钠溶液,立即有气体产生,因为氢离子过量,碳酸根直接与氢离子反应生成二氧化碳和水,离子方程式为:CO32-+2H+=CO2↑+H2O;
故答案为:碳酸根首先与氢离子反应生成碳酸氢根离子,使碳酸钠转化成了碳酸氢钠,因后者溶解度小于前者,所以有沉淀析出;Na++H++CO32-=NaHCO3↓;CO32-+2H+=CO2↑+H2O.
故答案为:先生成白色沉淀,然后沉淀逐渐溶解最后完全消失;Al3++4OH-=AlO2-+2H2O;
(2)将氢氧化钠溶液滴入氯化铝溶液,发生的反应方程式为:Al3++3OH-═Al(OH)3↓、Al(OH)3+NaOH═NaAlO2+2H2O,看到的现象是:先产生白色沉淀,最后沉淀溶解,根据消耗的氢氧化钠的量,产生沉淀和溶解沉淀的比为3:1;则A符合;将氯化铝溶液滴入氢氧化钠溶液,发生的反应方程式为:Al3++4OH-=AlO2-+2H2O;Al3++3AlO2-+6H2O=4Al(OH)3↓;看到的现象是:先无沉淀,最后生成沉淀,根据消耗的氯化铝的量,无沉淀和生成沉淀的比为3:1;则B符合,
故答案为:A;B;
(3)因为在饱和碳酸钠溶液中,逐滴加入稀盐酸,碳酸根首先与氢离子反应生成碳酸氢根离子,使碳酸钠转化成了碳酸氢钠,因后者溶解度小于前者,所以有沉淀析出,无气泡产生,反应离子方程式为:Na++H++CO32-=NaHCO3↓;在稀盐酸中,逐滴加入饱和碳酸钠溶液,立即有气体产生,因为氢离子过量,碳酸根直接与氢离子反应生成二氧化碳和水,离子方程式为:CO32-+2H+=CO2↑+H2O;
故答案为:碳酸根首先与氢离子反应生成碳酸氢根离子,使碳酸钠转化成了碳酸氢钠,因后者溶解度小于前者,所以有沉淀析出;Na++H++CO32-=NaHCO3↓;CO32-+2H+=CO2↑+H2O.
点评:本题考查离子反应及其反应过程的分析,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重图象分析、反应的先后顺序及与量有关的离子反应考查,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成分是( )
| A、氯化钙溶液 | B、漂白粉溶液 |
| C、次氯酸钠溶液 | D、氯水 |
下列物质的主要成分不是SiO2的是( )
| A、水晶 | B、石英 | C、沙子 | D、干冰 |
25℃某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,在常温下混合后pH=7,则酸溶液体积V酸和碱溶液体积V碱的正确关系为( )
| A、V碱=102V酸 |
| B、V酸=102 V碱 |
| C、V酸=2V碱 |
| D、V碱=2V酸 |
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4↓+2H2O,根据此反应判断下列叙述中正确是( )
| A、PbO2是电池的负极 |
| B、负极的电极反应式为:Pb+SO42--2e -=PbSO4↓ |
| C、PbO2得电子,被氧化 |
| D、电池放电时,溶液酸性增强 |
 从石油分馏产品C8H18制取二氢茉莉酮酸甲酯(香料)的流程如图:(备注:E是D的一元取代物)
从石油分馏产品C8H18制取二氢茉莉酮酸甲酯(香料)的流程如图:(备注:E是D的一元取代物)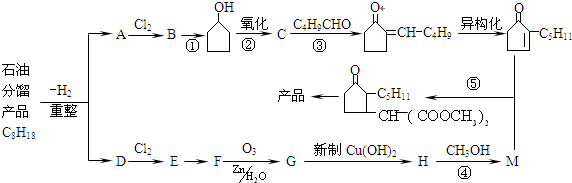
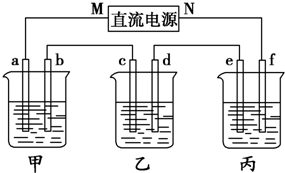 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.