题目内容
下列各项表达中不正确的是( )
A、Cl-的结构示意图为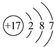 |
| B、D216O中,质量数之和是质子数之和的两倍 |
| C、在氮原子中,质子数为7而中子数不一定为7 |
| D、Be2+中的电子数和质子数之比一定为1:2 |
考点:原子结构示意图,质量数与质子数、中子数之间的相互关系
专题:原子组成与结构专题
分析:A.氯离子最外层电子式达到8电子稳定结构;
B.D216O的质量数之和为20,质子数之和为10;
C.质子数决定的元素种类,同种元素的原子可能含有不同的中子;
D.Be2+中的质子数为4,电子数为2.
B.D216O的质量数之和为20,质子数之和为10;
C.质子数决定的元素种类,同种元素的原子可能含有不同的中子;
D.Be2+中的质子数为4,电子数为2.
解答:
解:A.氯离子的核电荷数为17,核外电子总数为18,氯离子的结构示意图为 ,故A错误;
,故A错误;
B.D216O中,质量数之和为20,质子数之和为10,质量数之和是质子数之和的两倍,故B正确;
C.质子数决定了元素的种类,质子数和中子数决定了原子的种类,所以氮原子一定具有相同的质子数、核电荷数、核外电子数,但是不一定具有相同的中子数,故C正确;
D.Be2+中的电子数为2,质子数为4,电子数与质子数之比一定为1:2,故D正确;
故选A.
 ,故A错误;
,故A错误;B.D216O中,质量数之和为20,质子数之和为10,质量数之和是质子数之和的两倍,故B正确;
C.质子数决定了元素的种类,质子数和中子数决定了原子的种类,所以氮原子一定具有相同的质子数、核电荷数、核外电子数,但是不一定具有相同的中子数,故C正确;
D.Be2+中的电子数为2,质子数为4,电子数与质子数之比一定为1:2,故D正确;
故选A.
点评:本题考查了离子结构示意图的表示方法、质量数与中子数之间的关系,题目难度中等,注意掌握原子结构、离子结构示意图与原子结构示意图的表示方法及区别.

练习册系列答案
相关题目
下列各组中的反应,属于同一反应类型的是( )
| A、乙烯水化制乙醇;溴乙烷水解制乙醇 |
| B、甲苯使酸性高锰酸钾溶液褪色;乙烯一定条件下可与水反应生成乙醇 |
| C、乙醇脱水制乙烯;溴乙烷与NaOH乙醇溶液共热制乙烯 |
| D、苯的硝化;苯与氢气(镍作催化剂)制取环己烷 |
下列在指定溶液中的各组离子,能够大量共存的是( )
| A、无色溶液中:HCO3-、Na+、Cl-、OH- |
| B、pH=11的溶液中:S2-、K+、CO32-、Cl- |
| C、pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3- |
| D、pH=2的溶液中:Fe3+、SO42-、K+、SCN- |
物质的量浓度相等的氨水溶液与硫酸溶液等体积混合,则有关混合溶液中离子浓度关系不正确的是( )
| A、c(SO42-)>c(H+)>c(NH4+)>c(OH-) |
| B、c(H+)>c(SO42-)>c(NH4+)>c(OH-) |
| C、c(OH-)-c(NH4+)=c(H+)-2c(SO42-) |
| D、c(OH-)+c(NH3?H2O)=c(H+)-c(SO42-) |
对于铝热反应:Fe2O3+2Al
2Fe+Al2O3,下列说法中正确的是( )
| ||
| A、Fe元素的化合价升高 |
| B、Al被还原 |
| C、Fe2O3发生氧化反应 |
| D、每生成1mol Fe转移的电子为3mol |
某浓度的氨水中存在下列平衡:NH3?H2O?NH4++OH-,如想增大NH4+的浓度,而不增大OH-的浓度,应采取的措施是( )
| A、适当升高温度 |
| B、加入水 |
| C、通入NH3 |
| D、加入少量盐酸 |
下列叙述中,正确的是( )
| A、在多电子的原子里,能量高的电子通常在离核近的区域内运动 |
| B、核外电子总是先排在能量低的电子层里,例如一般先排满了L层后才排M层 |
| C、两种微粒,若核外电子排布完全相同,则其化学性质一定相同 |
| D、微粒的最外层只能是8个电子才稳定 |

