题目内容
 (Ⅰ) 水的电离平衡曲线如图所示.
(Ⅰ) 水的电离平衡曲线如图所示. (1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从
(2)将常温下的pH=8的Ba(OH)2溶液与常温下的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为
(Ⅱ)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
(3)若溶液中只溶解了一种溶质,该溶质的名称是
(4)若上述关系中C是正确的,则溶液中溶质的化学式是
(5)若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
考点:离子积常数,盐类水解的原理
专题:
分析:(Ⅰ)(1)Kw=c(H+).c(OH-);
(2)先根据水的离子积常数计算氢氧化钡溶液中c(OH-),再根据盐酸和氢氧化钡之间的关系计算氢氧化钡和盐酸的体积之比;
(Ⅱ)只存在OH-、H+、NH4+、Cl-四种离子的溶液,可能为氯化铵溶液、可能为氯化铵和盐酸的混合溶液、可能为氯化铵和氨水的混合溶液;
(3)若为NH4Cl溶液,由铵根离子水解来分析;
(4)C是正确的,c(H+)>c(NH4+),以此来分析;
(5)溶液呈中性,溶液中氢离子的浓度等于氢氧根浓度,据此解答即可.
(2)先根据水的离子积常数计算氢氧化钡溶液中c(OH-),再根据盐酸和氢氧化钡之间的关系计算氢氧化钡和盐酸的体积之比;
(Ⅱ)只存在OH-、H+、NH4+、Cl-四种离子的溶液,可能为氯化铵溶液、可能为氯化铵和盐酸的混合溶液、可能为氯化铵和氨水的混合溶液;
(3)若为NH4Cl溶液,由铵根离子水解来分析;
(4)C是正确的,c(H+)>c(NH4+),以此来分析;
(5)溶液呈中性,溶液中氢离子的浓度等于氢氧根浓度,据此解答即可.
解答:
解:(Ⅰ)(1)25℃时纯水中C(H+)=C(OH-)=10-7 mol/L,Kw=c(H+).c(OH-)=10-14 ,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+).c(OH-)=10-12 ;故答案为:10-14 ;10-12;
(2)将pH=8的Ba(OH)2溶液中c(OH-)=10-4 mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,
设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,
c(OH-)=
=10-5 mol/L,c(OH-)=
=10-5 mol/L,解得x:y=2:9,
故答案为:2:9;
(Ⅱ)只存在OH-、H+、NH4+、Cl-四种离子的溶液,可能为氯化铵溶液、可能为氯化铵和盐酸的混合溶液、可能为氯化铵和氨水的混合溶液;
(3)若为NH4Cl溶液,名称为氯化铵,因铵根离子水解,水解显酸性,则离子浓度为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:氯化铵;A;
(4)C是正确的,c(H+)>c(NH4+),则该溶液应为HCl和NH4Cl溶液,故答案为:HCl和NH4Cl;
(5)溶液呈中性,据c(Cl-)+c(OH-)=c(NH4+)+c(H+)可得c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水浓度大于盐酸浓度,如小于或等于,则溶液呈酸性,
故答案为:<;=.
(2)将pH=8的Ba(OH)2溶液中c(OH-)=10-4 mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,
设氢氧化钡的体积为x,盐酸的体积为y,100℃的恒温,欲使混合溶液pH=7,溶液呈碱性,
c(OH-)=
| 10-12 |
| 10-7 |
| 10-4x-10-5y |
| x+y |
故答案为:2:9;
(Ⅱ)只存在OH-、H+、NH4+、Cl-四种离子的溶液,可能为氯化铵溶液、可能为氯化铵和盐酸的混合溶液、可能为氯化铵和氨水的混合溶液;
(3)若为NH4Cl溶液,名称为氯化铵,因铵根离子水解,水解显酸性,则离子浓度为c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:氯化铵;A;
(4)C是正确的,c(H+)>c(NH4+),则该溶液应为HCl和NH4Cl溶液,故答案为:HCl和NH4Cl;
(5)溶液呈中性,据c(Cl-)+c(OH-)=c(NH4+)+c(H+)可得c(Cl-)=c(NH4+),因氨水为弱电解质,若该溶液中由体积相等的稀盐酸和氨水混合而成,则氨水浓度大于盐酸浓度,如小于或等于,则溶液呈酸性,
故答案为:<;=.
点评:本题考查溶液pH的简单计算、离子浓度大小的比较,注意溶液中溶质的判断及离子的水解为解答的难点,明确浓度与pH的换算、酸碱混合溶液为碱性时离子浓度的关系等是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
 某同学研究铝及其化合物的性质时设计了如下两个实验方案.
某同学研究铝及其化合物的性质时设计了如下两个实验方案.方案①:2.7g Al
| 100mlHCL |
| NaOH |
方案②:2.7g Al
| 100mlNaOH |
| HCL |
NaOH和HCl的浓度均是3mol/L,如图是向X溶液和Y溶液中分别加入NaOH和HCl时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是( )
| A、X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B、b曲线表示的是向X溶液中加入NaOH溶液 |
| C、在O点时两方案中所得溶液浓度相等 |
| D、a、b曲线表示的反应都是氧化还原反应 |
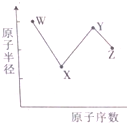 短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )
短周期元素W、X、Y和Z的原子半径随原子序数的变化如图所示.在周期表中,W和X的族序数之和等于Z的族序数.其中X的单质是空气的成分之一,元素Y是地壳中含量最丰富的金属元素,元素Z的原子最外层电子数是其电子层数的2倍.下列叙述不正确的是( )| A、W的简单离子半径小于氢元素的简单阴离子的半径 |
| B、Y与Z形成的化合物可以通过溶液中复分解获取 |
| C、运输Z的最高价氧化物对应水化物的浓溶液可用Y单质材料容器 |
| D、X的简单氢化物的沸点比Z的简单氢化物的沸点高 |
下列化学反应的离子方程式书写不正确的是( )
| A、碳酸钙与盐酸的反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| B、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-=Mg(OH)2↓ |
| C、氧化铜与稀H2SO4反应:CuO+2H+=Cu2++H2O |
| D、金属钠跟水反应:2Na+2H2O=2Na++2OH-+H2↑ |
全球气候变暖.下列哪种气体的增加是导致这种情况出现的主要原因( )
| A、N2 |
| B、O2 |
| C、CO2 |
| D、SO2 |
 某化学兴趣小组对原电池中盐桥的作用进行探究,并设计了以下实验装置:
某化学兴趣小组对原电池中盐桥的作用进行探究,并设计了以下实验装置:
 电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义.
电解池、原电池对于金属冶炼、实验室研究具有十分重要的意义. (R、R表示烃基)则该原电池的负极反应式为
(R、R表示烃基)则该原电池的负极反应式为