题目内容
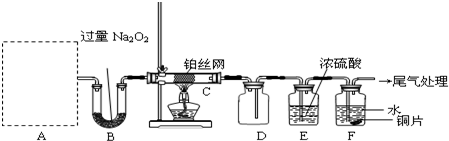
 如图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生.此时水浴加热,发生化学反应.过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出.试回答:
如图是某化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水硫酸铜粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中分别盛浓硫酸;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗的活塞后,由于浓硫酸流入B中,则D中导管口有气泡产生.此时水浴加热,发生化学反应.过几分钟,无水硫酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出.试回答:(1)B逸出的主要气体名称
(2)D瓶的作用是
(3)E管的作用是
(4)F管口点燃的气体分子式
(5)A瓶中无水硫酸铜粉末变蓝的原因是
(6)A中发生的方程式:
考点:性质实验方案的设计
专题:
分析:将C中浓H2SO4滴入B中浓盐酸中,由于浓H2SO4有吸水性,且溶于水要放出大量的热,故B中逸出HCl(g),经D中浓H2SO4干燥,进入A中,HCl溶于C2H5OH中,二者发生反应:C2H5OH+HCl
C2H5Cl+H2O,CuSO4吸收水分变为蓝矾,促使上列反应向右进行,加热时,生成的C2H5Cl从F处逸出,点燃火焰呈绿色,以此解答该题.
| △ |
解答:
解:(1)浓盐酸在浓硫酸作用下,由于浓H2SO4有吸水性,且溶于水要放出大量的热,可促使盐酸的挥发,生成氯化氢气体,
故答案为:氯化氢;
(2)D中为浓硫酸,进入D中的气体为氯化氢,浓硫酸可起到吸收氯化氢气体中混有的水蒸气的作用,
故答案为:吸收氯化氢气体中混有的水蒸气;
(3)E导管较长,可起到冷凝回流的作用,故答案为:冷凝乙醇蒸气;
(4)点燃火焰呈绿色,说明F出燃烧的气体为CH3CH2Cl,故答案为:CH3CH2Cl;
(5)A瓶中无水硫酸铜变蓝,说明反应有水生成,即氯化氢与乙醇发生取代反应生成水,水与无色CuSO4粉末结合生成蓝色的CuSO4晶体,
故答案为:反应产物有H2O生成,水与无色CuSO4粉末结合生成蓝色的CuSO4晶体;
(6)由A中发生的反应事实,可说明生成水和CH3CH2Cl,证明醇分子中的羟基可被氯化氢分子中的氯原子取代,其反应的方程式为:C2H5OH+HCl
C2H5Cl+H2O,
故答案为:C2H5OH+HCl
C2H5Cl+H2O.
故答案为:氯化氢;
(2)D中为浓硫酸,进入D中的气体为氯化氢,浓硫酸可起到吸收氯化氢气体中混有的水蒸气的作用,
故答案为:吸收氯化氢气体中混有的水蒸气;
(3)E导管较长,可起到冷凝回流的作用,故答案为:冷凝乙醇蒸气;
(4)点燃火焰呈绿色,说明F出燃烧的气体为CH3CH2Cl,故答案为:CH3CH2Cl;
(5)A瓶中无水硫酸铜变蓝,说明反应有水生成,即氯化氢与乙醇发生取代反应生成水,水与无色CuSO4粉末结合生成蓝色的CuSO4晶体,
故答案为:反应产物有H2O生成,水与无色CuSO4粉末结合生成蓝色的CuSO4晶体;
(6)由A中发生的反应事实,可说明生成水和CH3CH2Cl,证明醇分子中的羟基可被氯化氢分子中的氯原子取代,其反应的方程式为:C2H5OH+HCl
| △ |
故答案为:C2H5OH+HCl
| △ |
点评:本题考查物质的性质实验,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作注意事项,题目难度中等.

练习册系列答案
相关题目
固体粉末X中可能含有FeO、Fe2O3、MnO2、K2S、K2SO3、KAlO2、MgCl2、K2SO4、K2CO3、NaNO2中的若干种.为确定该固体粉末的成分,现取X进行连续实验,实验过程及产物如下:
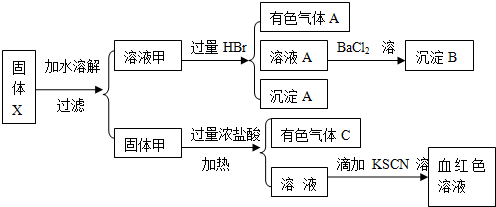
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A、原混合物中一定含有Fe2O3 |
| B、气体A一定均为纯净物 |
| C、气体C是纯净的氯气 |
| D、溶液甲中一定含有K2S、K2SO3、NaNO2、K2SO4可能含有KAlO2、K2CO3 |
只用氢氧化钠溶液不能除去下列各组物质中的杂质(括号中是杂质)的是( )
| A、Mg(Al2O3) |
| B、MgCl2(AlCl3) |
| C、Mg(Al) |
| D、MgO(Al2O3) |
1mol某有机物在稀硫酸作用下,水解生成2摩相同的物质.下列物质中:①蔗糖 ②麦芽糖 ③淀粉④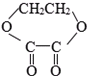 ⑤
⑤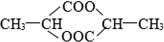 ⑥
⑥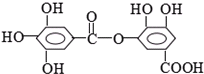
符合题意的物质可能是( )
 ⑤
⑤ ⑥
⑥
符合题意的物质可能是( )
| A、①②⑤ | B、②④⑤ |
| C、②⑤⑥ | D、①④⑤⑥ |
一种激素类药物的结构如下,下列有关叙述中不正确的是( )


| A、1mol该有机物完全燃烧需要22 mol O2 |
| B、可与NaOH发生反应 |
| C、1mol该有机物可以与7mol Br2发生反应 |
| D、该有机物遇FeCl3溶液呈紫色 |