题目内容
9.下列除杂方法不正确的是( )| A. | 若二氧化碳气体中混有少量的一氧化碳气体,可用点燃的方法除去 | |
| B. | 将铜粉中混有的少量铁粉除去,加入过量的CuSO4溶液充分反应后,过滤、洗涤干燥 | |
| C. | 将KNO3固体中混有的少量NaCl固体除去,可以用冷却KNO3的热饱和溶液、过滤即可 | |
| D. | 若氧气中混有少量的二氧化碳气体,可将混合气体通过足量的NaOH溶液后干燥 |
分析 A.二氧化碳多,CO不易点燃;
B.Fe与硫酸铜反应生成硫酸亚铁和Cu;
C.二者溶解度受温度影响不同;
D.二氧化碳与NaOH反应,而氧气不反应.
解答 解:A.二氧化碳多,CO不易点燃,则点燃不能除杂,故A错误;
B.Fe与硫酸铜反应生成硫酸亚铁和Cu,则加入过量的CuSO4溶液充分反应后,过滤、洗涤干燥可除杂,故B正确;
C.二者溶解度受温度影响不同,则用冷却KNO3的热饱和溶液、过滤即可,故C正确;
D.二氧化碳与NaOH反应,而氧气不反应,则将混合气体通过足量的NaOH溶液后干燥可除杂,故D正确;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.将5.6g铁粉投入盛有100mL 2mol•L-1 稀硫酸的烧杯中,2min 时铁粉刚好溶解完全.如果反应前后溶液的体积不变,则该反应的平均速率可表示为( )
| A. | v(Fe)=0.5 mol•L-1•min-1 | B. | v(H2SO4)=1 mol•L-1•min-1 | ||
| C. | v(H2)=0.05 mol•L-1•min-1 | D. | v(FeSO4)=0.5 mol•L-1•min-1 |
20.无机化合物可根据其组成和性质进行分类:

(1)上述所示物质分类方法的名称是树状分类法.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
(3)写出⑦转化为⑤的化学方程式:2NaOH+CO2═Na2CO3+H2O.
(4)写出①与③反应的离子方程式:H++OH-=H2O.
(5)写出②与⑤反应的离子方程式:CO32-+2H+=H2O+CO2↑.
(6)书写下列反应的离子方程式
①Fe与CuSO4溶液反应:Fe+Cu2+=Cu+Fe2+;
②CaCO3和稀盐酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O.

(1)上述所示物质分类方法的名称是树状分类法.
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O |
(4)写出①与③反应的离子方程式:H++OH-=H2O.
(5)写出②与⑤反应的离子方程式:CO32-+2H+=H2O+CO2↑.
(6)书写下列反应的离子方程式
①Fe与CuSO4溶液反应:Fe+Cu2+=Cu+Fe2+;
②CaCO3和稀盐酸溶液:CaCO3+2H+=Ca2++CO2↑+H2O.
17.下列说法中正确的是( )
| A. | 1mol•L-1的NaCl溶液是指由1mol NaCl和1000mL水配制成的溶液 | |
| B. | 从1L 0.5mol•L-1的NaCl溶液中取出100mL,剩余溶液物质的量浓度为0.45mol•L-1 | |
| C. | 标准状况下,18克H2O所含的氧原子数目为NA | |
| D. | 0℃时,2mol Cl2的体积不可能为22.4L |
10.下列属于弱电解质的是( )
| A. | 硅 | B. | 氨气 | C. | 醋酸 | D. | 氢氧化钡 |
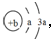 ,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题:
,Y、Z为同周期金属元素,其中Y为短周期元素中原子半径最大的元素,Z为地壳中含量最高的金属元素,W的最高价氧化物对应水化物可以与其气态氢化物反应生成盐G,盐G溶液呈酸性,回答下列问题: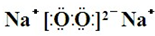 ,所含有的化学键类型为离子键和共价键.
,所含有的化学键类型为离子键和共价键.