题目内容
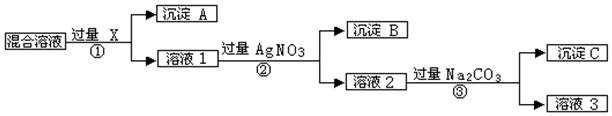
4.(1)同温同压下,同体积甲烷和二氧化碳分子数之比1:1 物质的量之比1:1原子总数之比5:3,质量之比4:11 密度之比4:11(2)在标况下,4克氢气、11.2升氧气、1摩尔水这种,所含分子数最多的为4g H2质量最大的为H2O 体积最小的为H2O.
分析 (1)同温同压下,相同体积的气体的物质的量相等,含有相同分子数目,甲烷分子含有原子数目为甲烷分子的5倍,二氧化碳分子含有原子数目为二氧化碳分子的3倍,进而计算分子含有的原子数目之比,根据物质的量和气体的摩尔质量计算质量和密度关系;
(2)依据n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$,结合1个氢气分子含有2个氢原子,1个氧气分子含有2个氧原子,1个水分子含有3个原子解答.
解答 解:(1)同温同压下,相同体积的气体物质的量相同,分子数目相同,则物质的量之比为1:1,分子数之比为1:1,
甲烷的分子式为CH4,1个分子中含有5个原子,二氧化碳的分子式为CO2,1个分子中含有3个原子,相同物质的量的气体原子数之比为5:3,
甲烷的相对分子质量为16,二氧化碳的相对分子质量为44,则质量之比为16:44=4:11,
体积相同,则密度之比等于物质的质量之比,也为4:11,
故答案为:1:1;1:1;5:3;4:11;4:11;
(2)4g氢气的物质的量n(H2)=$\frac{4g}{2g/mol}$=2mol,含有原子数为4NA;标况下体积为:2mol×22.4L/mol=44.8L;
11.2L氧气的物质的量n(O2)=$\frac{11.2L}{22.4L/mol}$=0.5 mol,含有原子数为0.5mol×2×NA=NA;质量为0.5mol×32g/mol=16g;
1mol H2O含有原子数为1mol×3×NA=3NA;质量为1mol×18g/mol=18g;标况下体积V=$\frac{18g}{1g/mL}$=18mL;
依据N=n×NA,分子个数与物质的量成正比,所以在标准状况下,4g H2、11.2L O2、1mol H2O中,所含分子数最多的是:4g H2;
所以含原子数最多的是:4g H2;质量最大的是水,体积最小为液态水,
故答案为:H2;H2O;H2O.
点评 本题考查了物质的量的有关计算,明确n=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$,即可解答,题目难度不大,侧重考查学生对基础知识掌握熟练程度,注意标况下水是液体.

 名校课堂系列答案
名校课堂系列答案| A. | 用四氯化碳萃取碘水中的碘的实验,分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时剩余少量液体停止加热 | |
| D. | 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
| A. | 进入煤矿矿井时,用火把照明 | |
| B. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| C. | 实验时,蒸发结晶时,当有大量晶体析出时再用玻璃棒搅拌 | |
| D. | 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标 |
| A. | 分离甲苯和二甲苯混合物 | B. | 分离硝酸苯和水的混合物 | ||
| C. | 分离碳酸钡和碳酸钠溶液 | D. | 分离碘的四氯化碳和水 |
| A. | 若二氧化碳气体中混有少量的一氧化碳气体,可用点燃的方法除去 | |
| B. | 将铜粉中混有的少量铁粉除去,加入过量的CuSO4溶液充分反应后,过滤、洗涤干燥 | |
| C. | 将KNO3固体中混有的少量NaCl固体除去,可以用冷却KNO3的热饱和溶液、过滤即可 | |
| D. | 若氧气中混有少量的二氧化碳气体,可将混合气体通过足量的NaOH溶液后干燥 |
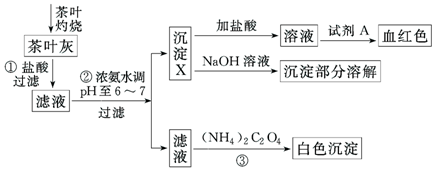
已知Ca2+、Al2+、Fe3+完全形成相应氢氧化物沉淀的pH如下表:
| Ca(OH)2 | Al(OH)3 | Fe(OH)3 | |
| pH | ≥13 | ≥5.2 | ≥4.1 |
(2)步骤②中调节pH至6~7的目的是使Fe3+、Al3+转化为沉淀.
(3)沉淀X所含主要物质的化学式为Al(OH)3、Fe(OH)3 .
(4)写出沉淀X与NaOH溶液反应的化学方程式Al(OH)3+NaOH=NaAlO2+2H2O;写出步骤③中发生反应的离子方程式:Ca2++C2O42-=CaC2O4↓.
(5)试剂A为硫氰化钾溶液.
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3•H2O;c(NH4+)由大到小的顺序是:②>①>③>④ | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+)+c(H+)=c(S2-)+c (HS-)+c(OH-) | |
| D. | AgCl悬浊液中存在平衡:AgCl(s)?Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,Ksp减少 |