题目内容
5.25℃时,测得某NH4Cl和Na2CO3溶液的pH值分别为5和10,则两溶液中水电离产生的c(H+)之比是( )| A. | 1:10 | B. | 2:1 | C. | 105:1 | D. | 5:1 |
分析 铵根离子和碳酸根离子都促进了水的电离,常温下pH=5的NH4Cl溶液中水电离出的氢离子浓度为10-5mol/L,pH=11的Na2CO3溶液中水电离出氢离子浓度为10-4mol/L,据此计算出两溶液中水电离产生的c(H+)之比.
解答 解:铵根离子和碳酸根离子都促进了水的电离,常温下pH=5的NH4Cl溶液中水电离出的氢离子浓度为10-5mol/L,
pH=11的Na2CO3溶液中氢氧根离子浓度为10-4mol/L,则水电离出氢离子浓度为10-4mol/L,
所以两溶液中水电离产生的c(H+)之比=10-5mol/L:10-4mol/L=1:10,
故选A.
点评 本题考查了溶液pH的计算、水的电离及其影响,题目难度中等,明确水的电离及其影响为解答关键,注意掌握溶液酸碱性与溶液pH的关系及计算方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
16.氯的原子序数为17,35Cl是氯的一种同位素,下列说法不正确的是( )
| A. | 35Cl原子所含质子数为18 | |
| B. | 35Cl2气体的摩尔质量为70 | |
| C. | 3.5g的35Cl2气体的体积为2.24L | |
| D. | 1/18mol的H35Cl分子所含中子数约为6.02×1023 |
13.下列说法正确的是( )
| A. | 铜和铁都是热和电的良导体 | |
| B. | 棉纱和蚕丝都属于蛋白质 | |
| C. | 玻璃和光导纤维都是硅酸盐材料 | |
| D. | 聚乙烯和聚氯乙烯都可制成食品保鲜膜 |
20.下列关于合金的叙述不正确的是( )
| A. | 合金一定是多种金属的混合物 | B. | 合金的性能往往比纯金属优越 | ||
| C. | 合金的熔点一般比其组成金属低 | D. | 合金的硬度一般比其组成金属大 |
10.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液:K+、Na+、Cu2+、SO42- | |
| B. | 使石蕊变红的溶液:Al3+、NO3-、Fe2+、Cl- | |
| C. | 使酚酞变红的溶液:Na+、Cl-、NO3-、SO42- | |
| D. | 0.1 mol•L-1 FeSO4溶液:K+、NH4+、MnO4-、ClO- |
17.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是 ( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物能 ⑦风能 ⑧氢能.
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物能 ⑦风能 ⑧氢能.
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ③⑤⑦ | D. | ③④⑤⑥⑦⑧ |
14.已知非金属单质A2、B2、C2之间能发生如下反应:A2+2B-=2A-+B2,B2+2C-=2B-+C2.以下说法正确的是( )
| A. | 单质活泼性:C2>B2>A2 | B. | 还原性:A->B->C- | ||
| C. | 氧化性:A2>B2>C2 | D. | 反应:A2+2C-=2A-+C2不能发生 |
15.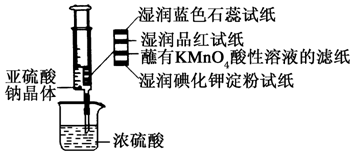 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
 如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )
如图所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是( )| A. | 湿润的蓝色石蕊试纸先变红后褪色 | |
| B. | 湿润的品红试纸,蘸有KMnO4酸性溶液的滤纸均褪色证明了SO2的漂白性 | |
| C. | 湿润的碘化钾淀粉试纸未变蓝说明SO2氧化性强于I2 | |
| D. | 实验后,可把注射器中的物质推入NaOH溶液,以减少环境污染 |