题目内容
20.下列关于合金的叙述不正确的是( )| A. | 合金一定是多种金属的混合物 | B. | 合金的性能往往比纯金属优越 | ||
| C. | 合金的熔点一般比其组成金属低 | D. | 合金的硬度一般比其组成金属大 |
分析 合金为金属与金属或金属与非金属融合而成的化合物,一般来说,合金的熔点低、硬度大,以此解答该题.
解答 解:A.合金可以是金属和非金属的混合物,故A错误;
B.合金是金属与金属或金属于非金属的混合物,硬度大,熔点低,耐腐蚀,机械性能好,故B正确;
C.合金为混合物,则熔点一般比其组成金属低,故C正确;
D.合金具有优良的机械性能,硬度比它的各成分金属大,故D正确.
故选A.
点评 本题主要考查合金与合金的性质,为高频考点,侧重化学与生产的考查,有利于培养学生良好的科学素养,注意合金的硬度大,熔点低,耐腐蚀.本考点基础性强,题目难度不大.

练习册系列答案
相关题目
1.图中所示的实验方法、装置或操作完全正确的是( )
| A. |  振荡分液漏斗 | B. |  稀释浓硫酸 | ||
| C. |  制蒸馏水 | D. |  称取NaOH |
8.下列变化中,必须由给出的物质与某种氧化剂发生反应才可实现的是( )
| A. | NH3→NO | B. | Fe3+→Fe2+ | C. | Cl2→NaClO | D. | NO2→HNO3 |
15.在注射之前,需要进行皮肤敏感性试验,目前属于最重要的抗生素是( )
| A. | 青霉素 | B. | 阿司匹林 | C. | 麻黄碱 | D. | 碳酸钙 |
5.25℃时,测得某NH4Cl和Na2CO3溶液的pH值分别为5和10,则两溶液中水电离产生的c(H+)之比是( )
| A. | 1:10 | B. | 2:1 | C. | 105:1 | D. | 5:1 |
12. 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液电导率如图所示.下列说法不正确的是( )
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液电导率如图所示.下列说法不正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液电导率如图所示.下列说法不正确的是( )| A. | 曲线①代表滴定CH3COOH溶液的曲线 | |
| B. | 在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C | |
| C. | D点溶液中:c(Cl-)=2c(OH-)-2c(H+) | |
| D. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol•L-1 |
10.已知还原性:Fe2+>Br-,向100mlFeBr2溶液中通入3.36L(标准状况下)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
| A. | 2mol/L | B. | 1.5mol/L | C. | 1mol/L | D. | 0.5mol/L |
 ;
;
 ;
;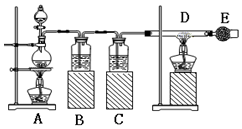 已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题:
已知:氯化铁易潮解.如图是制取无水氯化铁的实验装置图,将分液漏斗中的浓盐酸加入到盛有二氧化锰的烧瓶中,请回答下列问题: