题目内容
15.下列事实可以证明亚硝酸是弱酸的是( )①0.1mol/L HNO2溶液的pH=2;
②HNO2溶液不与Na2SO4溶液反应;
③HNO2溶液的导电性比盐酸弱;
④25℃时NaNO2溶液的pH大于7;
⑤将pH=2的HNO2溶液稀释至原体积的100倍,溶液的pH=3.7.
| A. | ①③④ | B. | ①④⑤ | C. | ②③④ | D. | ③④⑤ |
分析 能说明亚硝酸(HNO2)为弱电解质,可证明亚硝酸不能完全电离、存在电离平衡或对应的强碱盐溶液呈碱性,以此解答该题.
解答 解:①0.1mol/L HNO2溶液的pH=2,.说明亚硝酸不能完全电离,为弱电解质,证明为弱酸,故①正确;
②HNO2溶液不与Na2SO4溶液反应,只能说明不符合复分解反应的条件,但不能说明是弱酸,故②错误;
③等物质的量浓度的HNO2的导电能力比盐酸弱,说明亚硝酸溶液中亚硝酸没有完全电离,则证明了亚硝酸是弱酸,但溶液浓度不知,HNO2溶液的导电性比盐酸弱,不能说明亚硝酸为弱酸,故③错误;
④25℃时NaNO2溶液的pH大于7,NaNO2溶液为碱性,说明NaNO2是强碱弱酸盐,则说明HNO2为弱电解质,故④正确;
⑤将pH=2的HNO2溶液稀释至原体积的100倍,若为强酸则溶液PH增大2个单位,溶液PH=4,溶液的pH=3.7说明稀释后又电离出氢离子,能证明亚硝酸为弱酸,故⑤正确;
故选B.
点评 本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质 难度不大.

练习册系列答案
相关题目
6.对于下列几种化学符号,有关说法正确的是( )
①N;②Na+;③ ;④P2O5;⑤KClO3.
;④P2O5;⑤KClO3.
①N;②Na+;③
 ;④P2O5;⑤KClO3.
;④P2O5;⑤KClO3.| A. | 表示物质组成的化学式有①④⑤ | |
| B. | 表示阳离子的有②③ | |
| C. | ④中数字“5”表示五氧化二磷中有5个氧原子 | |
| D. | ⑤中各元素的质量比为1:1:3 |
20.下列实验操作方法正确的是( )
| A. | 欲除去乙烷中混有的乙烯可选用酸性KMnO4溶液洗气 | |
| B. | 使用萃取的方法可提纯粗苯甲酸 | |
| C. | 欲区分苯和甲苯,分别取少量样品加足量酸性KMnO4溶液,振荡,KMnO4溶液褪色为甲苯,反之为苯 | |
| D. | 欲确定溴乙烷中含有溴原子,加入适量NaOH溶液后加热,待溶液冷却后滴加AgNO3溶液,若生成淡黄色沉淀即可确定 |
7.实验室用锌片与稀硫酸反应制取氢气,加入少量下列物质能使氢气的速率加快的是( )
| A. | NaOH溶液 | B. | NaCl溶液 | C. | CuSO4溶液 | D. | 浓硝酸 |
4.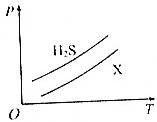 如图所示,表示1 g H2S与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
如图所示,表示1 g H2S与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
 如图所示,表示1 g H2S与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )
如图所示,表示1 g H2S与1g X气体在相同容积的密闭容器中压强(p)与温度(T)的关系,则X气体可能是( )| A. | N2 | B. | CH4 | C. | NO | D. | SO2 |
10.如图所示的电解池Ⅰ和Ⅱ中,有关说法不正确的是( )
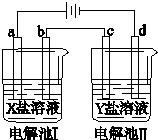

| A. | 若a是Zn,X是ZnSO4,则构成电镀池 | |
| B. | 当Y是硫酸铜,要构成电解精炼铜,则c是粗铜,d是精铜,且电解过程中硫酸铜溶液浓度不变 | |
| C. | 当X是CuCl2,Y是Na2SO4,用惰性电极电解,在I、II电解池中产生的气体物质的量之比为2:3 | |
| D. | 若去除电源,把b和c换成盐桥,可能构成原电池 |
 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、AgNO3溶液、x溶液,a、b、c、d电极均为石墨电极.接通电源,经过一段时间后,乙中c电极质量增加.据此回答问题: 如图所示是某实验小组电解氯化钠溶液(含酚酞)的装置.有毒气体收集的装置省略没有画出,两电极均是石墨电极.
如图所示是某实验小组电解氯化钠溶液(含酚酞)的装置.有毒气体收集的装置省略没有画出,两电极均是石墨电极.