题目内容
3.某有机物呈酸性,其相对分子质量为60,完全燃烧后只生成CO2和H2O.已知该有机物中含碳40%,氢6.7%.请计算:(1)该有机物的分子式
(2)120g该有机物与足量NaHCO3溶液反应,生成的气体在标准状况下的体积.
分析 已知该有机物中含碳40%,氢6.7%,则含氧量为1-40%-6.7%=53.3%,结合相对分子质量为60可计算有机物含有C、H、O的个数,可确定分子式,该有机物与足量NaHCO3溶液反应,说明含有羧基,结合反应的方程式计算生成的气体在标准状况下的体积.
解答 解:(1)已知该有机物中含碳40%,氢6.7%,则含氧量为1-40%-6.7%=53.3%,
N(C)=$\frac{60×40%}{12}$=2,N(H)=$\frac{60×6.7%}{1}$=4,N(O)=$\frac{60×53.3%}{16}$=2,
可得有机物的分子式为C2H4O2,
答:该有机物的分子式为C2H4O2;
(2)120g该有机物的物质的量为$\frac{120g}{60g/mol}$=2mol,与足量NaHCO3溶液反应,说明含有羧基,应为CH3COOH,
方程式为CH3COOH+NaHCO3=CH3COONa+H2O+CO2↑,
1mol 22.4L
2mol V
V=44.8L,
答:生成的气体在标准状况下的体积44.8L.
点评 本题考查有机物化分子式确定及合成,关键根据燃烧法确定有机物分子组成,是高考中的常见题目,题目难度中等,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
13.将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述错误的是( )
| A. | 铜片作正极 | B. | 正极反应为:2H++2e-═H2↑ | ||
| C. | 溶液中的H+移向正极 | D. | 锌片作负极,锌发生还原反应 |
14.酚酞的结构如图所示,有关酚酞说法不正确的是( )


| A. | 分子式为C20H14O4 | |
| B. | 可以发生取代反应、加成反应、氧化反应 | |
| C. | 含有的官能团有羟基、酯基 | |
| D. | 1 mol该物质可与H2和溴水发生反应,消耗H2和Br2的最大值分别为10 mol 和4 mol |
18.关于如图所示装置的叙述中,正确的是( )
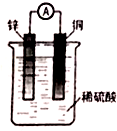

| A. | 铜片为电池的负极 | B. | 该装置将电能转化为化学能 | ||
| C. | 锌片的反应为Zn-2e-═Zn 2+ | D. | 电子由铜片经由导线流向锌片 |
8. 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是( )| A. | a为O2,b为CH4 | |
| B. | CO${\;}_{3}^{2-}$向正极移动 | |
| C. | 此电池在常温时也能工作 | |
| D. | 正极电极反应式为2CO2+O2+4e-═2CO${\;}_{3}^{2-}$ |
15.下列事实可以证明亚硝酸是弱酸的是( )
①0.1mol/L HNO2溶液的pH=2;
②HNO2溶液不与Na2SO4溶液反应;
③HNO2溶液的导电性比盐酸弱;
④25℃时NaNO2溶液的pH大于7;
⑤将pH=2的HNO2溶液稀释至原体积的100倍,溶液的pH=3.7.
①0.1mol/L HNO2溶液的pH=2;
②HNO2溶液不与Na2SO4溶液反应;
③HNO2溶液的导电性比盐酸弱;
④25℃时NaNO2溶液的pH大于7;
⑤将pH=2的HNO2溶液稀释至原体积的100倍,溶液的pH=3.7.
| A. | ①③④ | B. | ①④⑤ | C. | ②③④ | D. | ③④⑤ |
12.21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是( )
| A. | 海水含镁,将金属钠放入海水中可以制取金属镁 | |
| B. | 从海水中提取溴的过程涉及氧化还原反应 | |
| C. | 利用海水制取精盐不涉及化学反应 | |
| D. | 海底多金属结核矿含有Fe、Mn、Co、B等金属 |

 某研究性学习小组设计了两组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,D、E、F三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸条.已知常温下浓盐酸与高锰酸钾能反应生成氯气.
某研究性学习小组设计了两组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成N、C、Si三种非金属元素的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律.图2中,D、E、F三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸条.已知常温下浓盐酸与高锰酸钾能反应生成氯气.