题目内容
3.某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-(25℃时Ka=1.0×10-2),下列有关说法中正确的是( )| A. | H2A是弱酸 | |
| B. | 稀释0.1 mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1 mol/L的H2A溶液中,c(H+)=0.12 mol/L | |
| D. | 若0.1 mol/L NaHA溶液中c(H+)=0.02 mol/L,则0.1 mol/L的H2A中c(H+)<0.12 mol/L |
分析 A.二元酸(H2A)在水中第一步电离为完全电离;
B.加水稀释电离平衡正移,但氢离子浓度减小;
C.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-?H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,根据平衡常数计算溶液的c(H+);
D.H2A溶液中第一步电离出的氢离子,抑制了第二步电离.
解答 解:A.根据H2A=H++HA-可知,二元酸(H2A)在水中第一步电离为完全电离,则H2A酸性较强,不是弱酸,故A错误;
B.加水稀释电离平衡正移,但氢离子浓度减小,所以稀释0.1mol/L H2A溶液,电离平衡向右移动,c(H+)减小,故B错误;
C.二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-=H++A2-(Ka2=1.0×10-2),第一步完全电离,第二步部分电离,设电离的HA-为x,则:$\frac{(0.1+x).x}{0.1-x}$,解得:x=0.0084.所以在0.1mol•L-1的H2A溶液中,c(H+)=0.1mol/L+0.0084mol/L=0.1084mol/L,故C错误;
D.若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,0.1mol/L的H2A溶液中存在H2A═H++HA-,HA-?H++A2-,第一步电离出的氢离子,抑制了第二步电离,所以c(H+)<0.12mol/L,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡,涉及氢离子浓度的计算、电离常数的应用等知识,题目难度中等,注意该二元酸的电离特点,再结合守恒思想解答,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
13.在恒温恒容的容器中进行反应N2(g)+3H2(g)?2NH3(g),若起始c(N2)=0.1mol•L-1,4s后c(N2)=0.02mol•L-1需,那么前两秒内v(NH3)可能为( )
| A. | 0.02mol/(L•s) | B. | 0.04mol/(L•s) | C. | 0.06mol/(L•s) | D. | 0.03mol/(L•s) |
11.一定温度下,可逆反应A2(g)+3B2(g)?2AB3(g)达到平衡的标志是( )
| A. | 容器内每减少1mol A2,同时生成2mol AB3 | |
| B. | 容器内每减少1mol A2,同时生成3mol B2 | |
| C. | 容积一定时,容器内气体密度保持不变 | |
| D. | 容器内A2、B2、AB3的物质的量浓度相等 |
18.下列说法正确的是( )
| A. | 纤维素和淀粉的组成都可用(C6H10O5)n表示,它们互为同分异构体 | |
| B. | 油脂的酸性条件下的水解叫皂化反应 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl (s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
12.实验室里有200mLCH3COOCH2CH3,经检验,发现其中溶有少量CH3COOH.如果要除去这些CH3COOH,请选择下列中的有效方法( )
| A. | 蒸馏 | B. | 水洗后分液 | ||
| C. | 用过量饱和Na2CO3溶液洗涤后分液 | D. | 用过量NaCl溶液洗涤后分液 |
8.硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.
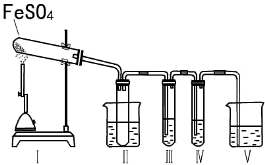
上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸(或“用作安全瓶”).
②装置Ⅲ中的试剂可以是C (选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是B、E.
A.2mol/LNa2CO3溶液 B.品红溶液 C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2 E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=35.7%(精确到0.1%)
(1)新制的绿矾(FeSO4•7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:4FeSO4•7H2O+O2=4Fe(OH)SO4+26H2O.
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃.
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”.

上述装置Ⅲ和Ⅳ用来检验气体产物.试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在 (选填“0℃、25℃、50℃”),装置Ⅱ的作用是防止产生倒吸(或“用作安全瓶”).
②装置Ⅲ中的试剂可以是C (选填序号,下同),现象是产生白色沉淀,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是B、E.
A.2mol/LNa2CO3溶液 B.品红溶液 C.0.5mol/L BaCl2溶液 D.0.5mol/LBa(NO3)2 E.0.01mol/L KMnO4溶液 F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为SO2+2OH-=SO32-+H2O.
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入KSCN溶液(或硫氰化钾溶液) | 溶液变成血红色 | 固体中含有Fe2O3 |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 固体中含有FeO |
 ,反应类型:加聚反应(或聚合反应)
,反应类型:加聚反应(或聚合反应) 反应类型:取代反应
反应类型:取代反应