题目内容
下表是元素周期表的一部分,请根据题目要求,回答下列有关问题
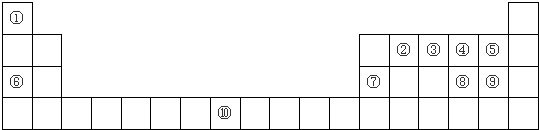
(1)①有多种核素,其中一种核素核内有一个中子,该核素符号为 .
②的最高价氧化物的结构式 ,所含化学键类型为 .
⑩号元素在周期表中的位置是 .
(2)⑤⑧⑨三种元素的原子半径的由大到小的顺序为 (用元素符号回答),⑤⑨两元素的气态氢化物在常温下都是气体,若同时降温,先液化的是 .(用化学式回答)
(3)⑤⑥两元素可形成化合物甲,用电子式表示甲的形成过程 .
(4)⑥、⑦两元素的最高价氧化物对应的水化物相互间反应的离子方程式为 .
(5)用一个化学方程式表示⑨的非金属比⑧的强 .
(6)元素③④形成的一种化合物乙,在常温下是一种红棕色的气体,将盛有乙与氧气的混合气体的试管倒立在装有水的水槽中,充分反应后,水充满试管,则乙与氧气的体积比为 .

(1)①有多种核素,其中一种核素核内有一个中子,该核素符号为
②的最高价氧化物的结构式
⑩号元素在周期表中的位置是
(2)⑤⑧⑨三种元素的原子半径的由大到小的顺序为
(3)⑤⑥两元素可形成化合物甲,用电子式表示甲的形成过程
(4)⑥、⑦两元素的最高价氧化物对应的水化物相互间反应的离子方程式为
(5)用一个化学方程式表示⑨的非金属比⑧的强
(6)元素③④形成的一种化合物乙,在常温下是一种红棕色的气体,将盛有乙与氧气的混合气体的试管倒立在装有水的水槽中,充分反应后,水充满试管,则乙与氧气的体积比为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨(10)分别是H、C、N、O、F、Na、Al、S、Cl、Fe元素,
(1)①元素符号左下角数字表示质子数、左上角数字表示质量数;
②的最高价氧化物是二氧化碳,二氧化碳分子中含有极性共价键;
⑩号元素是Fe元素;
(2)原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小;
含有氢键的氢化物熔沸点高,易液化;
(3)⑤⑥两元素可形成化合物甲为NaCl,Na原子和Cl原子通过得失的在形成氯化钠;
(4)⑥、⑦两元素的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水;
(5)氯气能氧化硫化氢生成硫单质;
(6)元素③④形成的一种化合物乙,在常温下是一种红棕色的气体,则乙是NO2,氧气、二氧化氮和水反应方程式为4NO2+O2+2H2O=4HNO3.
(1)①元素符号左下角数字表示质子数、左上角数字表示质量数;
②的最高价氧化物是二氧化碳,二氧化碳分子中含有极性共价键;
⑩号元素是Fe元素;
(2)原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小;
含有氢键的氢化物熔沸点高,易液化;
(3)⑤⑥两元素可形成化合物甲为NaCl,Na原子和Cl原子通过得失的在形成氯化钠;
(4)⑥、⑦两元素的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水;
(5)氯气能氧化硫化氢生成硫单质;
(6)元素③④形成的一种化合物乙,在常温下是一种红棕色的气体,则乙是NO2,氧气、二氧化氮和水反应方程式为4NO2+O2+2H2O=4HNO3.
解答:
解:根据元素在周期表中的位置知,①②③④⑤⑥⑦⑧⑨(10)分别是H、C、N、O、F、Na、Al、S、Cl、Fe元素,
(1)①有多种核素,其中一种核素核内有一个中子,该核素符号为12H,故答案为:12H;
②的最高价氧化物是二氧化碳,其结构式为O=C=O,二氧化碳分子中C原子和O原子之间含有极性共价键;故答案为:O=C=O;
⑩号元素是Fe元素,Fe元素位于第四周期第VIII族,故答案为:极性共价键;第四周期、第VIII族;
(2)原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,⑤的电子层数最少,⑧⑨电子层数相等,但⑧的原子序数小于⑨,所以这三种元素的原子半径的由大到小的顺序为S>Cl>F;
含有氢键的氢化物熔沸点升高,HF中含有氢键,所以⑤⑨两元素的气态氢化物在常温下都是气体,若同时降温,先液化的是HF,
故答案为:S>Cl>F;HF;
(3)⑤⑥两元素可形成化合物甲为NaCl,Na原子和Cl原子通过得失的在形成氯化钠,其形成过程为 ,
,
故答案为: ;
;
(4)⑥、⑦两元素的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)氯气能氧化硫化氢生成硫单质,反应方程式为H2S+Cl2=2HCl+S,故答案为:H2S+Cl2=2HCl+S;
(6)元素③④形成的一种化合物乙,在常温下是一种红棕色的气体,则乙是NO2,氧气、二氧化氮和水反应方程式为4NO2+O2+2H2O=4HNO3,要使溶液充满试管,则二氧化氮和氧气恰好反应生成硝酸,所以二氧化氮和氧气的体积之比为4:1,故答案为:4:1.
(1)①有多种核素,其中一种核素核内有一个中子,该核素符号为12H,故答案为:12H;
②的最高价氧化物是二氧化碳,其结构式为O=C=O,二氧化碳分子中C原子和O原子之间含有极性共价键;故答案为:O=C=O;
⑩号元素是Fe元素,Fe元素位于第四周期第VIII族,故答案为:极性共价键;第四周期、第VIII族;
(2)原子的电子层数越多其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,⑤的电子层数最少,⑧⑨电子层数相等,但⑧的原子序数小于⑨,所以这三种元素的原子半径的由大到小的顺序为S>Cl>F;
含有氢键的氢化物熔沸点升高,HF中含有氢键,所以⑤⑨两元素的气态氢化物在常温下都是气体,若同时降温,先液化的是HF,
故答案为:S>Cl>F;HF;
(3)⑤⑥两元素可形成化合物甲为NaCl,Na原子和Cl原子通过得失的在形成氯化钠,其形成过程为
 ,
,故答案为:
 ;
;(4)⑥、⑦两元素的最高价氧化物对应的水化物分别是NaOH、Al(OH)3,二者反应生成偏铝酸钠和水,离子反应方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)氯气能氧化硫化氢生成硫单质,反应方程式为H2S+Cl2=2HCl+S,故答案为:H2S+Cl2=2HCl+S;
(6)元素③④形成的一种化合物乙,在常温下是一种红棕色的气体,则乙是NO2,氧气、二氧化氮和水反应方程式为4NO2+O2+2H2O=4HNO3,要使溶液充满试管,则二氧化氮和氧气恰好反应生成硝酸,所以二氧化氮和氧气的体积之比为4:1,故答案为:4:1.
点评:本题考查了元素周期表和元素周期律的综合应用,根据元素周期表中的位置确定元素,再结合元素周期律、物质间的反应来分析解答,题目难度不大.

练习册系列答案
相关题目
下列各组物质之间不能发生置换反应的是( )
| A、碘水加入氯化钠溶液中 |
| B、铝片加入盐酸中 |
| C、钠投入水中 |
| D、溴水加入碘化钠溶液中 |
下列化合物属于弱电解质的是( )
| A、HCl |
| B、Ba(OH)2 |
| C、CO2 |
| D、HF |
 (1)书写化学方程式:①苯乙烯加聚反应;②丙烯与溴的加成反应
(1)书写化学方程式:①苯乙烯加聚反应;②丙烯与溴的加成反应 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答: