题目内容
有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为
(3)事实上,由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3(分解温度在500℃左右),反应的方程式是 .
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为
(3)事实上,由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3(分解温度在500℃左右),反应的方程式是
考点:常见金属元素的单质及其化合物的综合应用,化学方程式的书写
专题:信息给予题
分析:(1)按KClO3受热分解的方式分解,生成氧气;
(2)按CaCO3受热分解的方式分解,没有元素的化合价变化;
(3)由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3,结合反应物、生成物及电子守恒、原子守恒解答.
(2)按CaCO3受热分解的方式分解,没有元素的化合价变化;
(3)由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3,结合反应物、生成物及电子守恒、原子守恒解答.
解答:
解:(1)按KClO3受热分解的方式分解,FeSO4受热分解生成FeS和氧气,该反应为FeSO4
FeS+2O2↑,故答案为:FeSO4
FeS+2O2↑;
(2)按CaCO3受热分解的方式分解,没有元素的化合价变化,则FeSO4受热分解生成FeO和三氧化硫,该反应为FeSO4
FeO+SO3↑,故答案为:FeSO4
FeO+SO3↑;
(3)由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3,由反应物、生成物及电子守恒、原子守恒可知,Fe失去电子,S得到电子,则反应为2FeSO4
Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4
Fe2O3+SO2↑+SO3↑.
| ||
| ||
(2)按CaCO3受热分解的方式分解,没有元素的化合价变化,则FeSO4受热分解生成FeO和三氧化硫,该反应为FeSO4
| ||
| ||
(3)由于FeO易被氧化,FeSO4的分解产物是Fe2O3、SO2、SO3,由反应物、生成物及电子守恒、原子守恒可知,Fe失去电子,S得到电子,则反应为2FeSO4
| ||
| ||
点评:本题考查金属元素的单质及化合物性质的综合应用,为高频考点,侧重分析能力及知识迁移应用能力的考查,把握反应实质及氧化还原反应为解答的关键,题目难度中等.

练习册系列答案
相关题目
在一定温度下,可逆反应X(g)+3Y(g)?2Z(s)达到平衡的标志是( )
| A、X占混合气体的体积分数不变 |
| B、单位时间生成a molX,同时生成3a molY |
| C、X、Y、Z的浓度不再变化 |
| D、X、Y、Z的分子数比为1:3:2 |
 ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);
③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);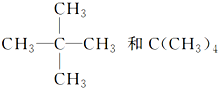
 .写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式
.写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式
 钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:
钛(Ti)被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白: