题目内容
某兴趣小组在课外活动中对某溶液进行了多次的检测,其中的三次检测结果如下表所示,请回答下列问题:
(1)三次检测结果中,第 次的结果肯定不正确.
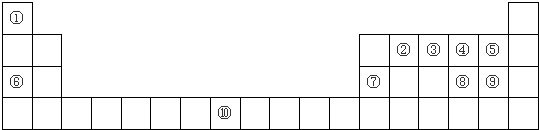
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
(3)在上述实验的第一步中,能否将硝酸改为稀盐酸? (填“能”或“不能”,如果填“能”,则不用说理由;如果填“不能”,则说明理由).
| 溶液中检测出的溶质 | |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2CO3、NaCl |
| 第三次 | KCl、K2CO3、Na2SO4、NaCl |
(2)在检测时,为了确定溶液中是否存在SO42-、CO32-和Cl-,该小组的学生进行了如下表所示的实验,请仔细分析实验,将表格补充完整:
| 实验步骤 | 实验操作 | 实验目的 | 反应的离子方程式 |
| 第一步 | 向溶液中滴加过量的硝酸 | 检验① |
② |
| 第二步 | 继续滴加过量的 ③ |
检验SO42-的存在 | ④ |
| 第三步 | 过滤,再向滤液中滴加 ⑤ |
检验 ⑥ |
Ag++Cl-=AgCl↓ |
考点:常见阴离子的检验
专题:物质检验鉴别题
分析:(1)第二次中,钡离子与碳酸根离子反应生成沉淀;
(2)确定溶液中是否存在SO42-、CO32-和Cl-,加硝酸生成气体为二氧化碳可检验CO32-,加Ba(NO3)2溶液生成白色沉淀可检验SO42-,向滤液中加硝酸银生成白色沉淀可检验Cl-,以此来解答;
(3)第三步需要检验氯离子,如果使用盐酸,会影响第三步氯离子的检验.
(2)确定溶液中是否存在SO42-、CO32-和Cl-,加硝酸生成气体为二氧化碳可检验CO32-,加Ba(NO3)2溶液生成白色沉淀可检验SO42-,向滤液中加硝酸银生成白色沉淀可检验Cl-,以此来解答;
(3)第三步需要检验氯离子,如果使用盐酸,会影响第三步氯离子的检验.
解答:
解:(1)第二次中,钡离子与硫酸根离子、碳酸根离子均反应生成沉淀,而第一次与第三次结果中,物质之间均不反应,即第二次的检测结果中,BaCl2、Na2CO3之间发生反应生成碳酸钡沉淀,所以第二步检验不正确,
故答案为:二;
(2)确定溶液中是否存在SO42-、CO32-和Cl-,为了避免干扰,应该先检验碳酸根离子,然后检验硫酸根离子,最后检验氯离子,具体检验方法为:加硝酸生成气体为二氧化碳可检验CO32-,发生离子反应为2H++CO32-=CO2↑+H2O;加Ba(NO3)2溶液生成白色沉淀可检验SO42-,发生离子反应为SO42-+Ba2+=BaSO4↓,向滤液中加硝酸银生成白色沉淀可检验Cl-,
故答案为:
(3)如果第一步加入盐酸,引进了氯离子,会干扰第三步检验氯离子的检验,所以不能使用盐酸,
故答案为:不能,因为加盐酸会干扰第三步Cl-的检测.
故答案为:二;
(2)确定溶液中是否存在SO42-、CO32-和Cl-,为了避免干扰,应该先检验碳酸根离子,然后检验硫酸根离子,最后检验氯离子,具体检验方法为:加硝酸生成气体为二氧化碳可检验CO32-,发生离子反应为2H++CO32-=CO2↑+H2O;加Ba(NO3)2溶液生成白色沉淀可检验SO42-,发生离子反应为SO42-+Ba2+=BaSO4↓,向滤液中加硝酸银生成白色沉淀可检验Cl-,
故答案为:
| 实验步骤 | 实验操作 | 实验目的 | 离子反应 |
| 第一步 | CO32- | 2H++CO32-=CO2↑+H2O | |
| 第二步 | Ba(NO3)2 | SO42-+Ba2+=BaSO4↓ | |
| 第三步 | AgNO3 | Cl- |
故答案为:不能,因为加盐酸会干扰第三步Cl-的检测.
点评:本题考查了常见离子的检验方法、物质的检验及实验方案的设计,把握离子的性质及离子之间的反应为解答的关键,明确复分解反应及常见离子检验方法即可解答,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质、弱电解质的电离都是吸热过程 |
| C、强电解质的饱和溶液一定是浓溶液,弱电解质的饱和溶液一定是稀溶液 |
| D、强电解质溶液的导电能力肯定比弱电解质溶液强 |
水溶液X中只可能溶有K+、Mg2+、Al3+、[Al(OH)4]-、SiO32-、SO32-、CO32-、SO42-中的若干种离子.某同学对该溶液进行了如下实验:

下列判断错误的是( )

下列判断错误的是( )
| A、气体甲可能是混合物 |
| B、沉淀甲是硅酸和硅酸镁的混合物 |
| C、白色沉淀乙的主要成分是氢氧化铝 |
| D、K+、[Al(OH)4]-和SiO32-一定存在于溶液X中 |
 ③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);
③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘、氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3);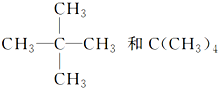
 一定温度下,向某容器固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:
一定温度下,向某容器固定的密闭容器中加入适量(NH4)2S固体,发生如下反应: .写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式
.写出由四氟乙烯在催化剂的条件下合成聚四氟乙烯的反应方程式