题目内容
 Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O═BO2-+4H2↑(反应实质为水电离出来的H+被还原).研究表明,该反应生成H2的速率受外界条件影响.下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).
Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O═BO2-+4H2↑(反应实质为水电离出来的H+被还原).研究表明,该反应生成H2的速率受外界条件影响.下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).| 体系 pH |
不同温度下NaBH4的半衰期(min) | |||
| 0℃ | 25℃ | 50℃ | 75℃ | |
| 8 | 4.32×100 | 6.19×10-1 | 8.64×10-2 | 1.22×10-2 |
| 10 | 4.32×102 | 6.19×101 | 8.64×100 | 1.22×100 |
| 12 | 4.32×104 | 6.19×103 | 8.64×102 | 1.22×102 |
| 14 | 4.32×106 | 6.19×105 | 8.64×104 | 1.22×104 |
(2)从上表可知,温度对NaBH4与水反应速率产生怎样的影响?
(3)反应体系的pH为何会对NaBH4与水反应的反应速率产生影响?
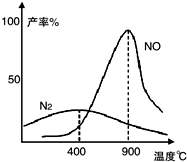
Ⅱ.肼(N2H4)又称联氨,常温下是一种无色油状液体,沸点为113.5℃.肼和氧气在不同温度和催化剂条件下生成不同产物(如图):
温度较低时主要发生反应①:N2H4+O2?N2+2H2O
温度较高时主要发生反应②:N2H4+2O2?2NO+2H2O
不考虑其他反应,完成下列天空:
(4)若反应①在250℃时的平衡常数K1,350℃时的平衡常数为K2,则K1
(5)反应②在1100℃时达到平衡后,下列措施中能使容器中
| n(NO) |
| n(O2) |
A.恒容条件下,充入He气 B.增大容器体积
C.恒容条件下,充入N2H4 D.使用催化剂
(6)若将n mol肼和2n mol O2充入某容积n L的刚性容器中,在800℃和一定压强、合适催化剂的作用下,反应①和②同时达到平衡,实验测得N2的产率为x,NO的产率为y,则该条件下反应②的平衡常数K=
考点:探究影响化学反应速率的因素,化学平衡的影响因素,化学平衡的计算
专题:实验设计题,化学平衡专题
分析:(1)依据NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应生成的盐溶液BO2-在溶液中水解显碱性分析判断溶液中离子浓度大小;
(2)依据图表数据分析,随温度升高体系半衰期缩短,反应速率加快;
(3)分析图表数据可知PH增大,半衰期增长,反应速率减慢;
(4)根据图象中氮气的产率变化可知,若反应①从250℃变为350℃,产率增多,平衡常数增大,则K1<K2;
(5)A.恒容条件下,充入He气,反应体系中个反应物及生成物的浓度均不变,平衡不移动,
不变;
B.增大容器体积,相当于减压,平衡右移,
增大;
C.恒容条件下,充入N2H4,平衡右移,
增大;
D.使用催化剂,平衡不移动,
不变;
(6)若将n mol肼和2n mol O2充入某容积n L的刚性容器中,则二者的起始浓度分别为1mol/L、2mol/L,
根据实验测得N2的产率为x,NO的产率为y,可知氮气的平衡浓度为x,NO的平衡浓度为2y,
①N2H4+O2?N2+2H2O
转化浓度 x x x 2x
②:N2H4+2O2?2NO+2H2O
转化浓度 y 2y 2y 2y
平衡浓度:c(N2H4)=(1-x-y)mol/L,c(O2)=(2-x-2y)mol/L,c(NO)=2ymol/L,c(H2O)=(2x+2y)mol/L,
则该条件下反应②的平衡常数K=
.
(2)依据图表数据分析,随温度升高体系半衰期缩短,反应速率加快;
(3)分析图表数据可知PH增大,半衰期增长,反应速率减慢;
(4)根据图象中氮气的产率变化可知,若反应①从250℃变为350℃,产率增多,平衡常数增大,则K1<K2;
(5)A.恒容条件下,充入He气,反应体系中个反应物及生成物的浓度均不变,平衡不移动,
| n(NO) |
| n(O2) |
B.增大容器体积,相当于减压,平衡右移,
| n(NO) |
| n(O2) |
C.恒容条件下,充入N2H4,平衡右移,
| n(NO) |
| n(O2) |
D.使用催化剂,平衡不移动,
| n(NO) |
| n(O2) |
(6)若将n mol肼和2n mol O2充入某容积n L的刚性容器中,则二者的起始浓度分别为1mol/L、2mol/L,
根据实验测得N2的产率为x,NO的产率为y,可知氮气的平衡浓度为x,NO的平衡浓度为2y,
①N2H4+O2?N2+2H2O
转化浓度 x x x 2x
②:N2H4+2O2?2NO+2H2O
转化浓度 y 2y 2y 2y
平衡浓度:c(N2H4)=(1-x-y)mol/L,c(O2)=(2-x-2y)mol/L,c(NO)=2ymol/L,c(H2O)=(2x+2y)mol/L,
则该条件下反应②的平衡常数K=
| (2x+2y)2(2y)2 |
| (1-x-y)(2-x-2y)2 |
解答:
解:(1)NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应生成的盐溶液BO2-在溶液中水解显碱性,溶液中离子浓度大小为c(Na+)>c(BO2-)>c(OH-)>c(H+),
故答案为:BH4-+2H2O=BO2-+4H2↑,c(Na+)>c(BO2-)>c(OH-)>c(H+);
(2)图表数据分析,随温度升高体系半衰期缩短,反应速率加快,故答案为:温度越大,反应速率越大;
(3)NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应实质为水电离出来的H+被还原,图表数据可知PH增大,半衰期增长,反应速率减慢,体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢,
故答案为:体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢;
(4)根据图象中氮气的产率变化可知,若反应①从250℃变为350℃,产率增多,平衡常数增大,则K1<K2,故答案为:<.
(5)A.恒容条件下,充入He气,反应体系中个反应物及生成物的浓度均不变,平衡不移动,
不变;
B.增大容器体积,相当于减压,平衡右移,
增大;
C.恒容条件下,充入N2H4,平衡右移,
增大;
D.使用催化剂,平衡不移动,
不变;
故答案为:BC;
(6)若将n mol肼和2n mol O2充入某容积n L的刚性容器中,则二者的起始浓度分别为1mol/L、2mol/L,
根据实验测得N2的产率为x,NO的产率为y,可知氮气的平衡浓度为x,NO的平衡浓度为2y,
①N2H4+O2?N2+2H2O
转化浓度 x x x 2x
②:N2H4+2O2?2NO+2H2O
转化浓度 y 2y 2y 2y
平衡浓度:c(N2H4)=(1-x-y)mol/L,c(O2)=(2-x-2y)mol/L,c(NO)=2ymol/L,c(H2O)=(2x+2y)mol/L,
则该条件下反应②的平衡常数K=
,故答案为:
.
故答案为:BH4-+2H2O=BO2-+4H2↑,c(Na+)>c(BO2-)>c(OH-)>c(H+);
(2)图表数据分析,随温度升高体系半衰期缩短,反应速率加快,故答案为:温度越大,反应速率越大;
(3)NaBH4与水反应制氢气:BH4-+2H2O=BO2-+4H2↑,反应实质为水电离出来的H+被还原,图表数据可知PH增大,半衰期增长,反应速率减慢,体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢,
故答案为:体系碱性越强,水电离出来的H+浓度越低,因而反应速率越慢;
(4)根据图象中氮气的产率变化可知,若反应①从250℃变为350℃,产率增多,平衡常数增大,则K1<K2,故答案为:<.
(5)A.恒容条件下,充入He气,反应体系中个反应物及生成物的浓度均不变,平衡不移动,
| n(NO) |
| n(O2) |
B.增大容器体积,相当于减压,平衡右移,
| n(NO) |
| n(O2) |
C.恒容条件下,充入N2H4,平衡右移,
| n(NO) |
| n(O2) |
D.使用催化剂,平衡不移动,
| n(NO) |
| n(O2) |
故答案为:BC;
(6)若将n mol肼和2n mol O2充入某容积n L的刚性容器中,则二者的起始浓度分别为1mol/L、2mol/L,
根据实验测得N2的产率为x,NO的产率为y,可知氮气的平衡浓度为x,NO的平衡浓度为2y,
①N2H4+O2?N2+2H2O
转化浓度 x x x 2x
②:N2H4+2O2?2NO+2H2O
转化浓度 y 2y 2y 2y
平衡浓度:c(N2H4)=(1-x-y)mol/L,c(O2)=(2-x-2y)mol/L,c(NO)=2ymol/L,c(H2O)=(2x+2y)mol/L,
则该条件下反应②的平衡常数K=
| (2x+2y)2(2y)2 |
| (1-x-y)(2-x-2y)2 |
| (2x+2y)2(2y)2 |
| (1-x-y)(2-x-2y)2 |
点评:本题考查了影响化学反应速率和化学平衡的因素、平衡常数的计算等,题干信息的应用和分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
2011年11月28日至12月9日在南非德班举行了国际气候变化大会,主要讨论减碳排放问题.从组成上分类下列物质可以与CO2分为同一类的物质是( )
| A、SiO2 |
| B、NaCl |
| C、K2CO3 |
| D、Al |
已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是( )
| A、铍的原子半径小于硼的原子半径 |
| B、氧化铍分子中铍原子的最外层电子数是8 |
| C、氢氧化铍的碱性比氢氧化钙的弱 |
| D、单质铍跟冷水反应产生氢气 |