题目内容
已知铍(Be)的原子序数为4.下列对铍及其化合物的叙述中,正确的是( )
| A、铍的原子半径小于硼的原子半径 |
| B、氧化铍分子中铍原子的最外层电子数是8 |
| C、氢氧化铍的碱性比氢氧化钙的弱 |
| D、单质铍跟冷水反应产生氢气 |
考点:同一主族内元素性质递变规律与原子结构的关系,同一周期内元素性质的递变规律与原子结构的关系
专题:元素周期律与元素周期表专题
分析:根据元素在同一周期半径的变化规律:从左到右原子半径逐渐减小;同一主族元素性质的递变规律:从上到下金属性逐渐增强等规律来分析解答.
解答:
解:A、同一周期,从左到右,元素原子半径逐渐减小,所以铍的原子半径大于硼的原子半径,故A错误;
B、铍(Be)的外层电子数为2,BeO分子中铍原子的最外层电子数是4,故B错误;
C、同一主族,从上到下,元素的金属性逐渐增强,所以钙的金属性强于铍,氢氧化钙的碱性比钙氢氧化铍的强,故C正确;
D、同一主族,从上到下,元素的金属性逐渐增强,所以镁的金属性强于铍,而镁与冷水不反应,所以铍跟冷水不反应,故D错误;
故选:C.
B、铍(Be)的外层电子数为2,BeO分子中铍原子的最外层电子数是4,故B错误;
C、同一主族,从上到下,元素的金属性逐渐增强,所以钙的金属性强于铍,氢氧化钙的碱性比钙氢氧化铍的强,故C正确;
D、同一主族,从上到下,元素的金属性逐渐增强,所以镁的金属性强于铍,而镁与冷水不反应,所以铍跟冷水不反应,故D错误;
故选:C.
点评:本题主要考查学生对元素周期律知识的理解与掌握,并能在解题中灵活应用,题目比较简单,明确同周期和同主族元素性质的递变规律是解题的关键.

练习册系列答案
相关题目
在无色透明的碱性溶液中,可以大量共存的一组离子是( )
| A、Na+、Fe3+、K+、NO-3 |
| B、K+、AlO2-、Na+、SO42- |
| C、NH4+、Al3+、NO-3、Cl- |
| D、K+、NO-3、Na+、Ag+ |
科学家用氘盐酸(DCl)和重水(D2O)溶液处理样品,对收集的气体加以分析,结果只发现有一些气体状态的碳氘化合物.这个实验不能用普通盐酸,其理由是( )
| A、普通盐酸的酸性太强 |
| B、普通盐酸具有挥发性 |
| C、普通盐酸和月球岩石中的碳化物无法反应 |
| D、无法区别岩石中原来含有的是含碳而不含普通氢的化合物,还是含碳和普通氢的化合物 |
已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断 裂时吸收热量496kJ,氢气中1mol H-H键断裂时吸收热量为436kJ,求水蒸气中1mol H-O键形成时放出热量( )
| A、463kJ |
| B、557kJ |
| C、486kJ |
| D、188kJ |
如图是立方烷的球棍模型,下列有关说法不正确的是( )
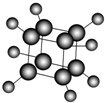

| A、其一氯代物只有一种 |
| B、其二氯代物有三种 |
| C、分子中σ键均由sp3-s电子云重叠而成 |
| D、它与苯乙烯(C6H5-CH=CH2)互为同分异构体 |
室温下,强酸性溶液中能大量共存的离子组是( )
| A、NH4+、Cu2+、Cl-、NO3- |
| B、K+、Na+、SO32-、S2- |
| C、K+、Na+、AlO2-、SO42- |
| D、Ba2+、Fe2+、SO42-、Br- |
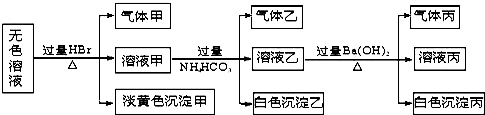
 Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O═BO2-+4H2↑(反应实质为水电离出来的H+被还原).研究表明,该反应生成H2的速率受外界条件影响.下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).
Ⅰ.施莱辛(Schlesinger)等人提出可用NaBH4与水反应制氢气:BH4-+2H2O═BO2-+4H2↑(反应实质为水电离出来的H+被还原).研究表明,该反应生成H2的速率受外界条件影响.下表为pH和温度对NaBH4半衰期的影响(半衰期是指反应过程中,某物质的浓度降低到初始浓度一半时所需的时间).