题目内容
5.如表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题: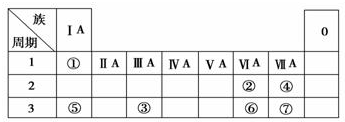
(1)③⑤⑥⑦中原子半径最大的是Na(用元素符号表示,下同),②③④⑤的简单离子中半径最小的是Al3+.
(2)③⑤中元素的金属性强弱顺序为Na>Al,⑥⑦元素的非金属性强弱顺序为Cl>S.
(3)①、②两种元素按原子个数比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式H2O2+2Fe2++2H+═2Fe3++2H2O.
(4)碳酸钠溶液呈碱性的原因CO32-+H2O?HCO3-+OH-.(用离子方程式表示)
分析 由元素在周期表的位置可知,①~⑦分别为H、O、Al、F、Na、S、Cl,
(1)同周期从左向右原子半径减小,具有相同电子排布的离子中原子序数大的离子半径小;
(2)同周期从左向右金属性减弱、非金属性增强;
(3)酸性溶液中过氧化氢能将Fe2+氧化;
(4)碳酸钠溶液水解显碱性.
解答 解:由元素在周期表的位置可知,①~⑦分别为H、O、Al、F、Na、S、Cl,
(1)同周期从左向右原子半径减小,具有相同电子排布的离子中原子序数大的离子半径小,则③⑤⑥⑦中原子半径最大的是Na,②③④⑤的简单离子中半径最小的是Al3+,
故答案为:Na;Al3+;
(2)同周期从左向右金属性减弱、非金属性增强,则③⑤中元素的金属性强弱顺序为Na>Al,⑥⑦元素的非金属性强弱顺序为Cl>S,
故答案为:Na>Al;Cl>S;
(3)酸性溶液中过氧化氢能将Fe2+氧化,发生的氧化还原反应为H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
(4)碳酸钠溶液水解显碱性,水解离子反应为CO32-+H2O?HCO3-+OH-,故答案为:CO32-+H2O?HCO3-+OH-.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素化合物等为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用及盐类水解,题目难度不大.

练习册系列答案
相关题目
18.下列关于${\;}_{43}^{99}$Tc的叙述正确的是( )
| A. | 原子序数是99 | B. | 质量数是43 | C. | 中子数是99 | D. | 电子数是43 |
19.把原子A 到F 的资料填入如表,并回答
(1)写出原子B、D、F的名称氧、硫、铝
(2)写出D原子的结构示意图
(3)写出E离子的电子式 .
.
| 原子 | 核电荷数 | 质量数 | 质子数 | 中子数 | 电子数 | 核外电子数 |
| A | 4 | 8 | ||||
| B | 6 | 8 | ||||
| C | 12 | 2、8、1 | ||||
| D | 16 | 16 | ||||
| E | 16 | 8 | ||||
| F | 27 | 2、8、3 |
(2)写出D原子的结构示意图

(3)写出E离子的电子式
 .
.
16.下列说法正确的是( )
| A. | 为了减少脂肪的摄入,应该少吃肉制品,植物制品则可随意吃 | |
| B. | 保鲜膜、一次性食品袋的主要成分都是聚氯乙烯 | |
| C. | 蛋白质、淀粉和油脂都属于高分子化合物,一定条件下都能水解 | |
| D. | 鸡蛋白溶液中加入饱和硫酸铵溶液析出了沉淀,这种变化不是蛋白质的变性 |
10.下列离子方程式书写正确的是( )
| A. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O═2Cu+O2↑+4H+ | |
| B. | 用银氨溶液检验乙醛的醛基:CH3CHO+2[Ag(NH3)2]++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
14.如图是铝热反应的实验装置,有关该反应的下列说法中一定正确的是( )


| A. | a为镁条 | |
| B. | b为氧化铁与铝粉的混合物 | |
| C. | 2 mol氧化剂参与反应则电子转移6 NA个 | |
| D. | 还原剂与氧化产物的物质的量之比为1:2 |
15.下列物质露置在空气中,不会变质的是( )
| A. | 硫 | B. | 氢硫酸 | C. | 烧碱 | D. | 亚硫酸 |