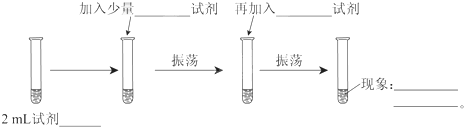
题目内容
17.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5分钟后,测得A的物质的量为0.3mol,D的浓度为0.1mol/L,C的平均反应速率是0.01mol/(L•min),求:(1)5分钟后B的浓度及开始前放入容器中A、B的物质的量.
(2)以B表示该反应的平均反应速率.
(3)x的值是多少?
分析 经5分钟后,测得A的物质的量为0.3mol,D的浓度为0.1mol/L,生成D的物质的量为0.1mol/L×2=0.2mol,v(D)=$\frac{0.1mol/L}{5min}$=0.02mol/(L•min),C的平均反应速率是0.01mol/(L•min),由速率之比等于化学计量数之比,则$\frac{2}{x}=\frac{0.02mol/(L.min)}{0.01mol/(L.min)}$,解得x=1,设开始A、B的物质的量均为n,则
3A(g)+B(g)?C(g)+2D(g)
开始 n n 0 0
转化 0.3 0.1 0.1 0.2
5min 0.3 0.1 0.2,
再结合c=$\frac{n}{V}$、v=$\frac{△c}{△t}$、开始的量=转化的量+5min的量来计算.
解答 解:经5分钟后,测得A的物质的量为0.3mol,D的浓度为0.1mol/L,生成D的物质的量为0.1mol/L×2=0.2mol,v(D)=$\frac{0.1mol/L}{5min}$=0.02mol/(L•min),C的平均反应速率是0.01mol/(L•min),由速率之比等于化学计量数之比,则$\frac{2}{x}=\frac{0.02mol/(L.min)}{0.01mol/(L.min)}$,解得x=1,设开始A、B的物质的量均为n,则
3A(g)+B(g)?C(g)+2D(g)
开始 n n 0 0
转化 0.3 0.1 0.1 0.2
5min 0.3 0.1 0.2,
(1)由上述分析可知,A、B的开始物质的量均为0.3mol+0.3mol=0.6mol,则5min后B的物质的量浓度为$\frac{0.6mol-0.1mol}{2L}$=0.25mol/L,
答:5分钟后B的浓度为0.25mol/L,开始前放入容器中A、B的物质的量均为0.6mol;
(2)以B表示该反应的平均反应速率为$\frac{\frac{0.1mol}{2L}}{5min}$=0.01mol/(L•min),
答:以B表示该反应的平均反应速率为0.01mol/(L•min);
(3)由上述分析可知,x=1,答:x的值是1.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、反应速率的计算为解答的关键,侧重分析与计算能力的考查,注意反应速率与化学计量数成正比,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | FeCl2溶液(KSCN) | B. | KOH(盐酸) | ||
| C. | Na2SO3溶液(BaCl2) | D. | HCHO溶液(石蕊试液) |
| A. | 鸡蛋清的水溶液加饱和(NH4)2SO4溶液后,有白色物质析出 | |
| B. | NO2气体经加压变成无色液体 | |
| C. | 溴水滴入植物油中振荡褪色 | |
| D. | 用SO2漂白的草帽日久变黄 |

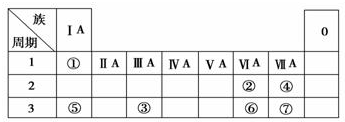
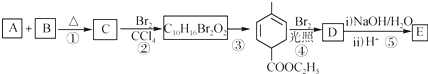
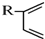 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$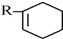
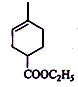 +Br2→
+Br2→ .
.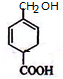 .
.