题目内容
下列说法正确的是( )
| A、室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、已知室温时,0.1mol?L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) |
| D、在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
考点:弱电解质在水溶液中的电离平衡,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.室温时某溶液的pH<7,该物质可能是强酸强碱酸式盐;
B.电离平衡常数=
=1×10-7,则c(H+)=
=10-4mol/L,电离度=
×100%;
C.混合溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.溶度积常数只与温度有关,温度不变,溶度积常数不变.
B.电离平衡常数=
| c(A-).c(H+) |
| c(HA) |
| 10-7×0.1 |
| c(HA)(电离) |
| c(HA)(总) |
C.混合溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.溶度积常数只与温度有关,温度不变,溶度积常数不变.
解答:
解:A.室温时某溶液的pH<7,该物质可能是强酸强碱酸式盐,如NaHSO4溶液,故A错误;
B.电离平衡常数=
=1×10-7,则c(H+)=
=10-4mol/L,电离度=
×100%=
×100%=0.1%,故B错误;
C.混合溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(CH3COO-),根据物料守恒得c(CH3COOH)+c(CH3COO-)=2c(Na+),所以得2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-),故C正确;
D.溶度积常数只与温度有关,温度不变,溶度积常数不变,向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4不一定析出,故D错误;
故选C.
B.电离平衡常数=
| c(A-).c(H+) |
| c(HA) |
| 10-7×0.1 |
| c(HA)(电离) |
| c(HA)(总) |
| 10-4mol/L |
| 0.1mol/L |
C.混合溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(H+)+c(Na+)=c(OH-)+c(CH3COO-),根据物料守恒得c(CH3COOH)+c(CH3COO-)=2c(Na+),所以得2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-),故C正确;
D.溶度积常数只与温度有关,温度不变,溶度积常数不变,向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4不一定析出,故D错误;
故选C.
点评:本题考查了弱电解质的电离、酸碱混合溶液大小判断、难溶物的溶解平衡等知识点,根据弱电解质的电离及电离度公式、盐的性质、溶度积常数与温度的关系等知识点来分析解答,易错选项是D,注意加入硫酸钠溶液和硫酸钠固体的区别,为易错点.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
下列结构中,从成键情况看,不合理的是( )
A、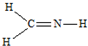 |
B、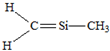 |
C、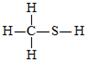 |
D、 |
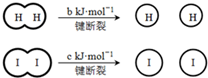 H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ?mol-1已知:(a、b、c均大于零)下列说法不正确的是( )
H2和I2在一定条件下能发生反应:H2(g)+I2(g)═2HI(g)△H=-a kJ?mol-1已知:(a、b、c均大于零)下列说法不正确的是( )| A、若b>c则相同条件下H2比I2稳定 |
| B、断开1mol H-H键和1mol I-I键所需能量大于断开2mol H-I键所需能量 |
| C、断开2mol H-I键所需能量约为(c+b+a)kJ |
| D、向密闭容器中加入1mol H2和2mol I2,充分反应后放出的热量小于2akJ |
已知a元素的阳离子,b元素的阴离子、c元素的阴离子具有相同的电子层结构,且b的阴离子半径大于c的阴离子半径,则其原子序数大小顺序为( )
| A、c>b>a |
| B、a>b>c |
| C、a>c>b |
| D、c>a>b |
某醇烯酸是合成香精的主要原料,其结构简式为: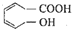 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )
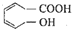 下列有关该醇烯酸的叙述正确的是( )
下列有关该醇烯酸的叙述正确的是( )| A、该醇烯酸的分子式为C7H8O3 |
| B、既可以通过加聚反应形成高分子,也可以通过缩聚反应形成高分子 |
| C、不能使酸性高锰酸钾溶液褪色 |
| D、分子内能形成六元环的酯 |
据报道,N5是破坏力极强的炸药之一,18O2是比黄金还要贵的物质,下列说法正确的是( )
| A、N5和N2互为同位素 |
| B、1个18O2中含有18个中子 |
| C、18O2与16O2的性质完全相同 |
| D、2N5=5N2是化学变化 |
决定气体体积的主要微观因素是( )
| A、气体分子的数目和分子本身的大小 |
| B、气体分子的质量和分子本身的大小 |
| C、气体分子的数目和分子间的平均距离 |
| D、气体分子本身的大小和分子间的平均距离 |
如图为一原电池的结构示意图,下列说法不正确的是( )
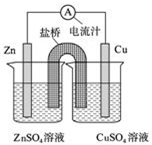

| A、原电池工作时的总反应为Zn+Cu2+═Zn2++Cu |
| B、原电池工作时,Zn电极流出电子,发生氧化反应 |
| C、若将Cu电极改为Fe电极,CuSO4溶液改为FeSO4溶液,Zn电极仍作负极 |
| D、盐桥中装有琼脂-饱和氯化钾溶液,则盐桥中的K+移向ZnSO4溶液 |