题目内容
如图为一原电池的结构示意图,下列说法不正确的是( )
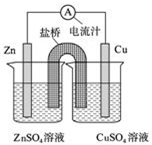

| A、原电池工作时的总反应为Zn+Cu2+═Zn2++Cu |
| B、原电池工作时,Zn电极流出电子,发生氧化反应 |
| C、若将Cu电极改为Fe电极,CuSO4溶液改为FeSO4溶液,Zn电极仍作负极 |
| D、盐桥中装有琼脂-饱和氯化钾溶液,则盐桥中的K+移向ZnSO4溶液 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:锌比铜活泼,锌为负极,发生氧化反应,电极方程式为Zn-2e-=Zn2+,铜为正极,发生还原反应,电极方程式为Cu2++2e-=Cu,原电池工作时,电子由负极经外电路流向正极,阳离子向正极移动,阴离子向负极移动,以此解答.
解答:
解;A.该原电池中,负极上锌失电子生成锌离子,正极上铜离子得到生成铜,电池反应式为:Zn+Cu2+=Zn2++Cu,故A正确;
B.该原电池中,易失电子的锌作负极,负极上锌失电子生成锌离子,发生氧化反应,故B正确;
C.如果将Cu电极改为Fe电极,锌的活泼性大于铁,所以Zn电极依然作负极,故C正确;
D.原电池工作时,阳离子向正极移动,即盐桥中的K+移向CuSO4溶液,故D错误.
故选D.
B.该原电池中,易失电子的锌作负极,负极上锌失电子生成锌离子,发生氧化反应,故B正确;
C.如果将Cu电极改为Fe电极,锌的活泼性大于铁,所以Zn电极依然作负极,故C正确;
D.原电池工作时,阳离子向正极移动,即盐桥中的K+移向CuSO4溶液,故D错误.
故选D.
点评:本题考查原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理和电极方程式的书写,难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
下列说法正确的是( )
| A、室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、已知室温时,0.1mol?L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) |
| D、在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
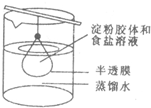 将10mL淀粉溶液和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图),2min后分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉溶液和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图),2min后分别取袋内和烧杯内液体进行实验.下列说法正确的是( )| A、用激光笔照射该烧杯中的液体,会产生丁达尔现象 |
| B、烧杯内液体加入碘水后呈蓝色 |
| C、该淀粉胶体在催化剂作用下可水解生成葡萄糖和果糖 |
| D、将烧杯中液体蒸干,得到的固体物质可用来制取纯碱 |
化学与生产和生活密切相关,下列说法正确的是( )
| A、金属钠可以保存在煤油或酒精中,防止在空气中变质 |
| B、石油的裂化和煤的干馏,都属于化学变化 |
| C、等质量的葡萄糖和果糖在人体内完全氧化释放的能量相等 |
| D、聚氯乙烯制品易造成白色污染,可采用焚烧法处理 |
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如图所示: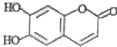 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A、该物质在酸性条件下加热可以水解 |
| B、1mol M最多能与3mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、1mol M与足量NaHCO3反应能生成2mol CO2 |
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体.下列说法错误的是( )| A、S2Cl2的结构中各原子均达到8电子的稳定结构 |
| B、S2Cl2为含有极性键和非极性键的共价化合物 |
| C、若S2Br2与S2Cl2结构相似,则熔沸点:S2Cl2>S2Br2 |
| D、S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O═SO2↑+3S↓+4HCl |
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是( )
| A、a原子的最外层电子数比B原子的最外层电子数少 |
| B、a原子电子层数比b原子的电子层数多 |
| C、1mol a从酸中置换H+生成的H2比b从酸中置换H+生成的H2要容易 |
| D、常温时,b能从水中置换出氢,而a不能 |
有a、b、c、d 4种金属,将a与b用导线连接起来,浸入NaCl溶液中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将铜浸在b盐溶液中,无明显变化;如果把铜浸入c的盐溶液中,有金属c析出.据此判断它们的活动性由强到弱的顺序是( )
| A、d>c>a>b |
| B、b>a>d>c |
| C、d>b>a>c |
| D、d>a>b>c |
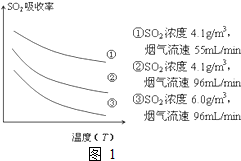 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.