题目内容
3.利用如图所示装置,将10mL CCl4(沸点76.7℃)和10mL甲苯(沸点110.6℃)的混合物进行蒸馏分离.下列说法正确的是( )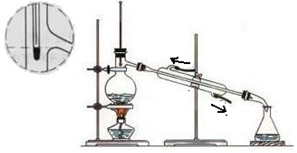
| A. | 冷凝水的进出口方向正确 | B. | 应选用20 mL的蒸馏烧瓶 | ||
| C. | 温度计液泡应插在混合液中 | D. | 锥形瓶中收集到的是甲苯 |
分析 由信息可知,二者互溶,但沸点不同,利用图中蒸馏装置可分离,温度计测定馏分的温度、冷水下进上出,沸点低的先被蒸馏出来,以此来解答.
解答 解:A.冷水在冷凝管中上进下出,图中合理,故A正确;
B.液体的体积为20mL,应选体积大于60mL的蒸馏烧瓶,故B错误;
C.温度计测定馏分的温度,不能插在混合液中,温度计的水银球在烧瓶的支管口处,故C错误;
D.CCl4的沸点低,先被蒸馏出,故D错误;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握习题中的信息及混合物分离方法为解答关键,侧重分析与实验能力的考查,注意实验装置及仪器的使用,题目难度不大.

练习册系列答案
相关题目
14.在体积可变的密闭容器中,反应 mA(g)+nB(s)?pC(g)达到平衡后,压缩容器的体积,发现 A 的转 化率随之降低.下列说法中正确的是( )
| A. | (m+n)必定小于 p | B. | (m+n)必定大于 p | C. | m 必定小于 p | D. | n 必定大于 p |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个NO2、N2O4分子的混合气体降低温度,混合气体的分子数目小于NA | |
| B. | 常温常压和光照条件下,33.6 LCl2与3.0g H2反应,生成的HCl分子数目为3NA | |
| C. | 1.68 g Fe和足量水蒸气反应,转移的电子数目为0.09NA | |
| D. | 一定条件下,1 mol N2和3 mol H2充分反应,生成物中含N-H键数目为6NA |
18.某地方政府为了实现对当地水资源及沿途流域环境的综合治理,引导甲、乙两个相邻的工厂在污水处理方面做了横向联合.已知两厂排放的污水经初步处理后,分别只有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-.两厂单独排放都会造成严重的水污染,如将两厂的污水按一定的比例混合,沉淀后污水便变成无色澄清的溶液而排放,污染程度会大大降低.关于污染源的分析,你认为正确的是( )
| A. | SO4-和NO3-可能来自同一工厂 | B. | Cl-和NO3-一定来自不同的工厂 | ||
| C. | Ag+和Na+可能来自同一工厂 | D. | Na+和NO3-来自同一工厂 |
8.根据下列有关图象,说法正确的是( )
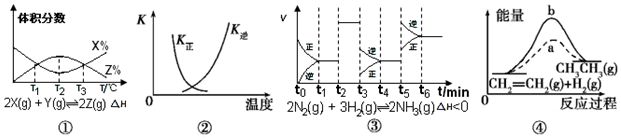

| A. | 由图①知,反应在T1、T3处达到平衡,且该反应的△H<0 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g),△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 由图③知,反应在t6时,NH3体积分数最大,t3时采取降低反应温度的措施 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
15.已知常温下,N2(气)和H2(气)生成2molNH3(气)放出92.4kJ热量.现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1molN2和3molH2,达到平衡时放出热量Q1kJ.②向密闭容器乙中通入0.5molN2和1.5molH2,达到平衡时放出热量Q2kJ.则下列关系式正确的是( )
| A. | Q1=2Q2=92.4 | B. | Ql>2Q2 | C. | Q1<2Q2 | D. | Q1=2Q2>92.4 |
13.下列各组中两稀溶液间的反应,可以用同一个离子方程式表示的是( )
| A. | H2SO4与K2CO3;HNO3与Na2CO3 | B. | CH3COOH与KOH;HCl与NaOH | ||
| C. | BaCl2与Na2SO4;Ba(OH)2与(NH4)2SO4 | D. | HCl与Na2CO3;HCl与NaHCO3 |