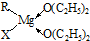题目内容
11.用惰性电极电解氯化钠溶液,请写出阳极反应式;2Cl--2e-=Cl2↑
阴极反应式2H2O+2e-=H2↑+2OH-;
总方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH
电解一段时间后,溶液的pH升高(填“升高”或“下降”).
分析 用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上水得电子生成氢气,同时溶液中还生成NaOH,电解后溶液中的溶质变为NaOH,据此分析解答.
解答 解:用惰性电极电解氯化钠溶液时,阳极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑;
阴极上水得电子生成氢气,电极反应式为2H2O+2e-=H2↑+2OH-;
同时溶液中还生成NaOH,电解后溶液中的溶质变为NaOH,电池反应式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,溶液碱性增强,溶液的pH升高,
故答案为:2Cl--2e-=Cl2↑;2H2O+2e-=H2↑+2OH-;2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;升高.
点评 本题考查电解原理,为高频考点,侧重考查学生分析判断能力,明确各个电极上发生的反应是解本题关键,熟记离子放电顺序,题目难度不大.

练习册系列答案
相关题目
1.肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol,N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=+1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol |
2.下列离子组在指定溶液中能大量共存的是( )
| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
19.若甲、乙、丙三种物质间的转化关系是甲?乙?丙,则甲、丙不可能是( )
| A. | Cl2 O2 | B. | Al(OH)3 AlCl3 | C. | FeCl3 Fe(OH)3 | D. | NaOH Na2CO3 |
6.做馒头时,在发酵面团中加入某种物质,既能除去面团中的酸,又能使馒头松软,加入的这种物质是( )
| A. | NaOH | B. | NaCl | C. | CaO | D. | Na2CO3 |
3.(1)下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上.
其中属于着色剂的有柠檬黄、日落黄,属于调味剂的有柠檬酸、甜蜜素、菠萝香精、蔗糖,属于防腐剂的有山梨酸钾,富含维生素的有浓缩菠萝汁、维生素C.
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故.亚硝酸钠和氯化钠的部分性质如表:
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:溶于水制成溶液,加入稀硫酸微热,有棕色气体生成者,原物质为NaNO2,否则为NaCl;或用酒精灯加热,熔化者为NaNO2,不熔者为NaCl;或取两支试管,各加入5mL水,分别溶解这两种物质,至不再溶解时,溶解量大的为亚硝酸钠,溶解量小的为氯化钠.
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等. |
(2)亚硝酸钠有毒,其外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故.亚硝酸钠和氯化钠的部分性质如表:
| 性质 | 亚硝酸钠 | 氯化钠 |
| 1.酸性条件下的稳定性 | 微热时分解为NO和NO2 | 微热时不分解 |
| 2.熔点 | 271℃ | 801℃ |
| 3.室温时的溶解度 | 约80g | 约35g |
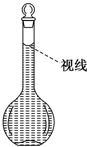 用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
用18mol/L的浓硫酸配制80mL 1.0mol/L的稀硫酸,需用的实验仪器有:A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
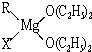 中的配位键
中的配位键