题目内容
14.现在有许多食盐都是加碘的,为什么要在食盐加碘?分析 碘盐中含有的是碘酸钾,再分析碘酸钾中含有碘元素,根据缺碘的症状考虑.
解答 解:碘盐中含有碘酸钾,碘酸钾属于一种物质,所以碘酸钾中含有碘元素,缺碘易得甲状腺肿大,所以要补充碘元素.
答:给人体补充碘元素,防止缺碘引起甲状腺肿大.
点评 解答本题关键是要熟悉物质和元素属于宏观概念,所以物质中含有元素,熟悉缺碘容易得的疾病.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案
相关题目
4.下列说法正确的是( )
| A. | 32g O2中含有32NA个电子 | |
| B. | 22.4L N2含有阿伏加德罗常数个氮分子 | |
| C. | 在标准状况下,22.4L水的质量约为18g | |
| D. | 常温常压下22g的CO2与标准状况下11.2L HCl含有相同的分子数 |
5.下列表示不正确的是( )
| A. | MgF2的电子式: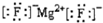 | B. | 二甲醚的结构式:CH3-O-CH3 | ||
| C. | NH3的球棍模型: | D. | 氧原子的结构示意图: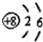 |
9.下列有关实验用品的使用或操作的叙述中,正确的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 分液时,上层液体从分液漏斗下口流出 | |
| C. | 在制取蒸馏水的实验中收集冷凝水时,应弃去开始蒸馏出的部分 | |
| D. | 在制取蒸馏水的实验中,冷水从冷凝管上口入,下口出 |
4. 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量
Fe3+、Al3+、Fe2+等杂质离子).
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
已知:金属离子氢氧化物沉淀所需pH如下表所示:
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是A(填字母序号).
A.MgO B.Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN)6])溶液不变色所需H2O2溶液的量来确定
粗硫酸镁中Fe2+的含量.已知,测定123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2溶液的体积如下表所示:
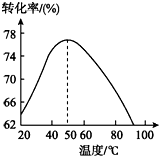
(3)工业上常以Mg2+的转化率为考察指标,确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件.其中,反应温度与Mg2+转化率的关系如图所示.
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.
②根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”)反应.
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
④Ksp表示沉淀溶解平衡的平衡常数.已知:
Mg(OH)2(s)?Mg2+(aq)+2OH-(aq) Ksp=c(Mg2+)•c2(OH-)=5.6×10-12
Ca(OH)2(s)?Ca2+(aq)+2OH-(aq) Ksp=c(Ca2+)•c2(OH-)=4.7×10-6
若用石灰乳替代氨水,能(填“能”或“不能”)制得氢氧化镁,理由是Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化.
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁(其中常含有少量
Fe3+、Al3+、Fe2+等杂质离子).
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
已知:金属离子氢氧化物沉淀所需pH如下表所示:
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
A.MgO B.Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN)6])溶液不变色所需H2O2溶液的量来确定
粗硫酸镁中Fe2+的含量.已知,测定123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2溶液的体积如下表所示:
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+.
②根据图中所示50℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”)反应.
③图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
④Ksp表示沉淀溶解平衡的平衡常数.已知:
Mg(OH)2(s)?Mg2+(aq)+2OH-(aq) Ksp=c(Mg2+)•c2(OH-)=5.6×10-12
Ca(OH)2(s)?Ca2+(aq)+2OH-(aq) Ksp=c(Ca2+)•c2(OH-)=4.7×10-6
若用石灰乳替代氨水,能(填“能”或“不能”)制得氢氧化镁,理由是Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化.
1.肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气.已知:N2(g)+2O2(g)═N2O4(g)△H=+8.7kJ/mol,N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534.0kJ/mol,下列表示肼跟N2O4反应的热化学方程式,正确的是( )
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=+1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol |
2.下列离子组在指定溶液中能大量共存的是( )
| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |