题目内容
15.已知有以下物质相互转化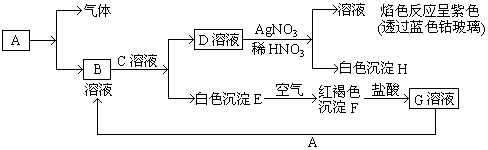
其中A是生活中常见的金属单质,它与盐酸反应生成浅绿色的B溶液和一种气体.试回答:
(1)写出A的化学式Fe,F的化学式Fe(OH)3.
(2)向G溶液中滴加KSCN溶液,现象为溶液呈血红色.
(3)写出由G转变成B的离子方程式为═2Fe3++Fe=3Fe2+.
(4)写出由E转变成F的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 A是生活中常见的金属单质,它与盐酸反应生成浅绿色的B溶液和一种气体,判断A为Fe,B为FeCl2,C为碱溶液,和氯化亚铁反应生成白色沉淀为氢氧化亚铁,溶液D加入硝酸酸化的硝酸银溶液生成白色沉淀H为AgCl,得到溶液焰色反应为隔着钴玻璃呈紫色,说明函钾离子,证明C溶液为KOH,白色沉淀E为Fe(OH)2,块钱中迅速变化为灰绿色最后变化为红褐色沉淀F为Fe(OH)3,加入盐酸反应得到G溶液为氯化铁溶液,氯化铁和铁反应生成氯化亚铁溶液,据此分析回答.
解答 解:A是生活中常见的金属单质,它与盐酸反应生成浅绿色的B溶液和一种气体,判断A为Fe,B为FeCl2,C为碱溶液,和氯化亚铁反应生成白色沉淀为氢氧化亚铁,溶液D加入硝酸酸化的硝酸银溶液生成白色沉淀H为AgCl,得到溶液焰色反应为隔着钴玻璃呈紫色,说明函钾离子,证明C溶液为KOH,白色沉淀E为Fe(OH)2,块钱中迅速变化为灰绿色最后变化为红褐色沉淀F为Fe(OH)3,加入盐酸反应得到G溶液为氯化铁溶液,氯化铁和铁反应生成氯化亚铁溶液,
(1)分析可知A为Fe,F为Fe(OH)3,故答案为:Fe;Fe(OH)3;
(2)向G溶液中滴加KSCN溶液,发生反应Fe3++3SCN-=Fe(SCN)3,溶液呈血红色,故答案为:溶液呈血红色;
(3)由G转变成B的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(4)E转变成F的反应是氢氧化亚铁被空气中氧气氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3 .
点评 本题综合考查无机物的推断,题目难度中等,解答本题注意以铁及其化合物特征性质和反应现象为突破口,注意相关物质的性质及应用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 熔点:金刚石>碳化硅>晶体硅 | B. | 沸点:NH3>PH3 | ||
| C. | 硬度:白磷>冰>二氧化硅 | D. | 熔点:SiI4>SiBr4>SoCl4 |
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率.
| A. | ①② | B. | ③④ | C. | ①②③ | D. | 全部 |
| A. | pH=3的盐酸和pH=5的硫酸溶液等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,存在H+ | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7mol•L-1 | |
| D. | 在0.1mol•L-1 HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
| A. | 标准状况下,22.4L水中含有的分子数是NA个 | |
| B. | 32g氧气中含有的分子数为NA | |
| C. | 1mol氯气与足量的氢氧化钠溶液反应,转移的电子数为2NA | |
| D. | 1L1mol/LCaCl2溶液中含有的氯离子数为NA |
| A. | 乙烷 | B. | 乙烯 | C. | 乙块 | D. | 甲醇 |
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 用氯化铁溶液腐蚀电路板:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 硫酸镁溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| D. | 钠和冷水反应:Na+H2O═Na++OH-+H2↑ |
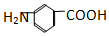 和
和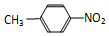 C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl
C、12C60和石墨 D、乙醇和乙二醇 E、35Cl和37Cl