题目内容
 NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.
NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.(1)写出NaHSO3溶液与过量KIO3溶液反应生成I2的离子方程式:
(2)调节反应物浓度和温度进行对比实验,记录结果如下:
| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 30 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
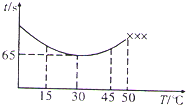
(3)改变反应温度,重复实验③,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(“×××”表示超过50℃后溶液不会再变蓝).
①在30℃下,若溶液变蓝时,I2的物质的量为nmol,则从反应开始至溶液变蓝,IO3-的平均反应速率
②根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:
(4)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小.课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设二和假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大反应速率越快;
假设二:
假设三:
…
(5)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定).
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
考点:探究影响化学反应速率的因素
专题:实验设计题
分析:(1)碘酸根离子具有强氧化性,能将亚硫酸氢根离子氧化;
(2)根据实验②知道溶液的体积是40mL,保证混合液的体积相等,据此确定溶液体积的大小;
(3)①根据v=
来计算化学反应速率;
②根据图象知道:温度30℃为分界点,低于该温度,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长,据此回答;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等,以此加以假设;
(5)通过对比实验进行验证.
(2)根据实验②知道溶液的体积是40mL,保证混合液的体积相等,据此确定溶液体积的大小;
(3)①根据v=
| △c |
| △t |
②根据图象知道:温度30℃为分界点,低于该温度,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长,据此回答;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等,以此加以假设;
(5)通过对比实验进行验证.
解答:
解:(1)碘酸根离子具有强氧化性,能将亚硫酸氢根离子氧化为硫酸根离子,本身被还原为碘单质,反应为:2IO3-+5HSO3-=5SO42-+I2+3H++H2O,
故答案为:2IO3-+5HSO3-=5SO42-+I2+3H++H2O;
(2)根据实验②知道溶液的体积是40mL,所以a=15,b=30,故答案为:15;30;
(3)①在30℃下,若溶液变蓝时,I2的物质的量为nmol,消耗碘酸根离子的物质的量是2nmol,IO3-的平均反应速率v=
=
=
mol/(L?s),
故答案为:
;
②根据图象知道:温度30℃为分界点,低于该温度,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长,故答案为:温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等加以假设,而在本实验中可能的原因为反应生成的I-对反应起催化作用,I-浓度越大反应速率越快或者反应生成的H+对反应起催化作用,H+浓度越大反应速率越快或者是反应放热,随着反应的进行,温度升高,反应速率加快,
故答案为:反应生成的I2对反应起催化作用,I2浓度越大反应速率越快;反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
(5)通过对比实验进行验证,具体步骤为在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙),若v(甲)=v(乙),则假设一不成立,若v(甲)<v(乙),则假设一成立,
故答案为:
.
故答案为:2IO3-+5HSO3-=5SO42-+I2+3H++H2O;
(2)根据实验②知道溶液的体积是40mL,所以a=15,b=30,故答案为:15;30;
(3)①在30℃下,若溶液变蓝时,I2的物质的量为nmol,消耗碘酸根离子的物质的量是2nmol,IO3-的平均反应速率v=
| △c |
| △t |
| ||
| 65s |
| 2n |
| 40×10-3×65 |
故答案为:
| 2n |
| 40×10-3×65 |
②根据图象知道:温度30℃为分界点,低于该温度,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长,故答案为:温度低于30℃时,温度越高,溶液变蓝所需时间越短;温度高于30℃时,温度越高,溶液变蓝所需时间越长;
(4)根据影响反应速率的外界因素有浓度、温度、催化剂等加以假设,而在本实验中可能的原因为反应生成的I-对反应起催化作用,I-浓度越大反应速率越快或者反应生成的H+对反应起催化作用,H+浓度越大反应速率越快或者是反应放热,随着反应的进行,温度升高,反应速率加快,
故答案为:反应生成的I2对反应起催化作用,I2浓度越大反应速率越快;反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
(5)通过对比实验进行验证,具体步骤为在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定其起始时的反应速率v(甲);在烧杯乙中预先加入少量Na2SO4粉末,其他条件与甲完全相同,进行同一反应,用速率检测仪测定其起始阶段相同时间内的反应速率v(乙),若v(甲)=v(乙),则假设一不成立,若v(甲)<v(乙),则假设一成立,
故答案为:
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将NaHSO3溶液与过量KIO3溶液混合,用测速仪测定其起始时的反应速率v(甲);在烧杯乙中进行同一反应(不同的是乙烧杯中预先加入少量Na2SO4或K2SO4粉末,其他反应条件均完全相同),测定其起始阶段的相同时间内的反应速率v(乙) | 若v(甲)=v(乙),则假设一不成立;若v(甲)<v(乙),则假设一成立 |
点评:本题主要考查浓度、催化剂对反应速率的影响,对学生的分析能力和逻辑推理能力有一定的要求,中等难度.

练习册系列答案
相关题目
取相同质量的C6H6、C7H8、C6H12、C4H10等烃,在完全燃烧时耗O2最多是( )
| A、C6H6 |
| B、C7H8 |
| C、C6H12 |
| D、C4H10 |
下列解释事实的化学方程式或离子方程式正确的是( )
| A、用食醋除去暖水瓶中的水垢:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O+H2O |
| C、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
| D、Ca(HCO3)2溶液中加入少量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |

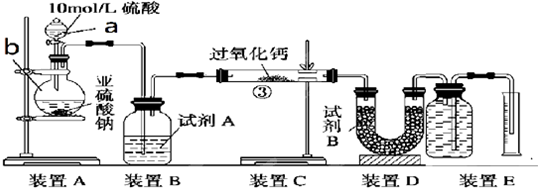
 某兴趣小组设计如图实验装置进行实验.
某兴趣小组设计如图实验装置进行实验.

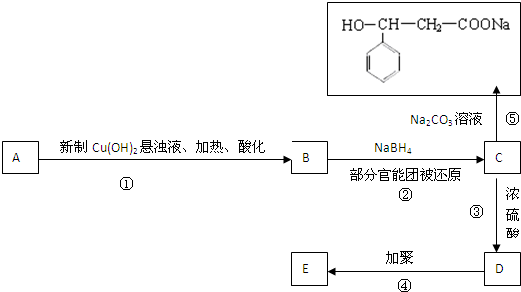
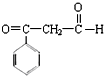 是一种重要的化工原料.A、B、C、D、E之间的转化关系如图:
是一种重要的化工原料.A、B、C、D、E之间的转化关系如图: