题目内容
4.下列说法正确的是( )| A. | 反应物具有的总能量总是高于生成物所具有总能量 | |
| B. | 需要加热方能发生的反应一定是吸热反应 | |
| C. | 构成原电池的正极和负极必须是两种不同的金属 | |
| D. | 决定化学反应速率的主要因素是参加反应的物质的性质 |
分析 A、当反应物所具有的总能量高于生成物所具有的总能量的反应为放热反应,反之为吸热反应;
B、反应能否在常温下进行,与是否放热无关;
C、构成原电池的正极和负极可以是两种不同的金属,也可以是金属和非金属;
D、决定化学反应速率的主要因素是物质本身的性质.
解答 解:A、化学反应有的吸热有的放热,反应物具有的总能量高于生成物所具有总能量,反应为放热反应,反之为吸热反应,故A错误;
B、反应能否在常温下进行,与是否放热无关,如铝热反应为放热反应,但在高温下进行,而氢氧化钡晶体与氯化铵的反应在常温下就可进行,但为吸热反应,故B错误;
C、构成原电池的正极和负极可以是两种不同的金属,也可以是金属和非金属,不一定都是金属做电极,故C错误;
D、决定化学反应速率的主要因素是物质本身的性质,故D正确.
故选D.
点评 本题考查了化学反应能量变化的实质理解应用和反应速率的影响因素知识,为高频考点,侧重于学生的分析能力的考查,题目较简单.

练习册系列答案
相关题目
15.下列说法或表示方法中正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 已知C(s)+$\frac{ax}{0.02}$O2(g)=CO(g)的反应热为110.5kJ/mol,说明碳的燃烧热为110.5kJ | |
| C. | 已知反应X+Y=M+N为放热反应,故不必加热就可发生 | |
| D. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于57.3KJ |
12.用三个烧杯组成如图所示装置进行下列实验,实验结果与预测现象不一致的是( )
| 选项 | ①中物质 | ②中物质 | 预测现象 |  |
| A | 酚酞溶液 | 浓氨水 | ①中无色变红色 | |
| B | CCl4 | 液溴 | ①中变橙色 | |
| C | 浓氨水 | 浓硫酸 | 空气中产生白烟 | |
| D | NaAlO2溶液 | 浓硝酸 | ①中有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
19.氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1mol氢气中的化学键消耗的能量为a kJ,破坏1mol氯气中的化学键消耗的能量为b kJ,形成1mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是( )
| A. | b>c | B. | a+b>2c | C. | a+b<c | D. | a+b<2c |
13.重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备.铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等.
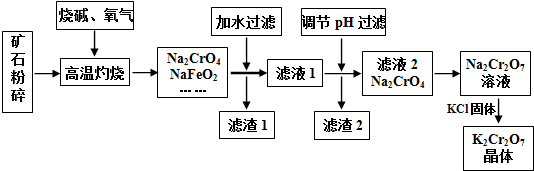
已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
①反应达到平衡时,溶液的pH=1,该反应平衡常数K为9.5×104.
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%

已知:①NaFeO2遇水强烈水解.②2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O请回答下列问题:
(1)将矿石粉碎的目的是增大反应物的表面积,加快反应速率;高温灼烧时Cr2O3发生反应的化学方程式为2Cr2O3+3O2+8NaOH$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4H2O.
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式FeO2-+2H2O=Fe(OH)3↓+OH-.滤渣2的主要成分是Al(OH)3和H2SiO3.
(3)用简要的文字说明Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小.
(4)25℃时,对反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
| 时间/(s) | 0 | 0.01 | 0.02 | 0.03 | 0.04 |
| (CrO42-)/(mol•L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
| (Cr2O72-)/(mol•L-1) | 0 | 9.2×10-2 | 9.4×10-2 | 9.5×10-2 |
②下列有关说法正确的bd.
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2:1时该反应已达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
14.下列关于硅元素及其化合物的有关说法不正确的是( )
| A. | SiO2是水晶、玛瑙的主要成分,也是制造光导纤维的原料 | |
| B. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 | |
| C. | 盛放NaOH溶液的试剂用橡皮塞,而不用玻璃塞 | |
| D. | Si是良好的半导体材料,是将太阳能转换为电能的常用材料 |




 .
.