题目内容
下列各组物质的晶体中,化学键类型和晶体类型都相同的是( )
| A、CO2和H2O |
| B、NaOH和CH4 |
| C、SiO2和CO2 |
| D、NaCl和HCl |
考点:化学键
专题:
分析:根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键.
解答:
解:A、固体CO2和H2O都是分子晶体,CO2和H2O都只含共价键,故A正确;
B、NaOH是离子晶体,NaOH中既含离子键,又含共价键,CH4是分子晶体,CH4中只含共价键,故B错误;
C、固体CO2是分子晶体,SiO2是原子晶体,SiO2和CO2都只含共价键,故C错误;
D、NaCl是离子晶体,NaCl中只含离子键,固体HCl分子晶体,HCl中只含共价键,故D错误;
故选A.
B、NaOH是离子晶体,NaOH中既含离子键,又含共价键,CH4是分子晶体,CH4中只含共价键,故B错误;
C、固体CO2是分子晶体,SiO2是原子晶体,SiO2和CO2都只含共价键,故C错误;
D、NaCl是离子晶体,NaCl中只含离子键,固体HCl分子晶体,HCl中只含共价键,故D错误;
故选A.
点评:本题考查化学键及晶体类型,熟悉化学键的形成规律及不同晶体中的构成微粒即可解答,题目难度不大.

练习册系列答案
相关题目
25℃时,已知弱酸的电离常数:Ka(CH3COOH)=1.75×10-4,Ka1(H2CO3)=4.4×10-7,Ka2(HCO3-)=4.7×10-11,Ka(HClO)=4.0×10-8,则下列说法正确的是( )
| A、25℃时,0.1mol.L-1的酸性溶液比0.1mol.L-1的醋酸溶液的K值小 |
| B、25℃时,甲基橙滴入0.1mol.L-1醋酸溶液中,溶液呈黄色 |
| C、等物质的量浓度的碳酸钠溶液,醋酸钠溶液,醋氯酸钠溶液pH.pH(Na2CO3)>pH(NaCN)>pH(CH3COONa) |
| D、新制氯水中有次氯酸,水和氯气分子,所用新制氯水与碳酸氢钠不反应 |
工业制硫酸的一步重要反应是SO2在400~600℃下的催化氧化:2SO2+O2
2SO3,这是一个正反应放热的可逆反应.如果反应在密闭容器中进行,下述有关说法错误的是( )
| 催化剂 |
| △ |
| A、使用催化剂是为了加快反应速率,提高生产效率 |
| B、在上述条件下,SO2不可能100%地转化为SO3 |
| C、为了提高SO2的转化率,应适当提高O2的浓度 |
| D、达到平衡时,SO2的浓度与SO3的浓度相等 |
已知A、B、C、D、E是短周期原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的最高正价与最低负价的代数和为零,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.则有关说法正确的是( )
| A、元素A、C、D的单质均能与E的单质反应,且反应均为放热反应 |
| B、元素D的最高价氧化物与B、C、E的最高价氧化物对应的水化物之间均能发生反应 |
| C、化合物AE与CE含有相同类型的化学键 |
| D、元素B、D分别与E形成的化合物中每个原子最外层均满足8电子的稳定结构 |
用下列装置进行相应实验,能达到实验目的是( )
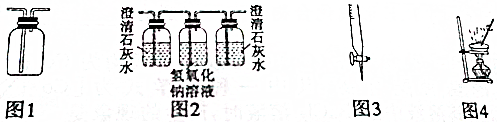

| A、用图1所示装置可以收集H2、NH3、CO2、NO2等气体 |
| B、用图2所示装置可以验证SO2气体中含有CO2气体 |
| C、用图3所示仪器可以量取Na2CO3溶液 |
| D、用图4所示装置可以进行硫酸铜晶体中结晶水含量的测定 |
下列醇不能发生消去反应的是( )
① ②
② ③CH3OH ④
③CH3OH ④
①
 ②
② ③CH3OH ④
③CH3OH ④
| A、①② | B、②④ | C、①③ | D、③④ |