题目内容
 C、N、S的单质和化合物在工农业生产中有重要的应用.
C、N、S的单质和化合物在工农业生产中有重要的应用.(1)甲烷为原料制取氢气是工业上常用的制氢方法.
已知:
CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJ?mol-1
则CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=
(2)工业上可采用下列反应合成甲醇:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0
若容器容积不变,下列措施可增加氢气转化率的是
A.升高温度 B.增加CO2的量
C.充入He,使体系总压强增大 D.按原比例再充入CO2和H2
(3)氨气、次氯酸钠按一定物质的量之比混合反应可制的联氨.写出该反应的化学方程式
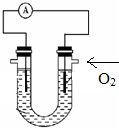
(4)某联氨-氧气-氢氧化钾溶液燃料电池如图所示电池工作时,OH-向U型管
(5)某温度下反应2SO2(g)+O2(g)?2SO3(g)的K=1620在1L的密闭容器中,充入0.2mol SO2、0.1mol O2和1.8mol SO3.则此时该反应
考点:热化学方程式,常见化学电源的种类及其工作原理,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)利用盖斯定律解答,从待求反应出发分析反应物生成物在所给反应中的位置,通过相互加减可得;
(2)若容器容积不变,可增加氢气转化率的措施即为化学平衡正向移动的措施;
(3)氨气具有还原性,次氯酸钠具有氧化性,二者按一定物质的量之比混合反应可生成联氨、氯化钠和水;
(4)在燃料点池中,通入氧气的电极是正极,该极上是氧气发生得电子的还原反应,电解质中的阴离子移向负极;
(5)根据Qc和K之间的关系确定反应的移动方向.
(2)若容器容积不变,可增加氢气转化率的措施即为化学平衡正向移动的措施;
(3)氨气具有还原性,次氯酸钠具有氧化性,二者按一定物质的量之比混合反应可生成联氨、氯化钠和水;
(4)在燃料点池中,通入氧气的电极是正极,该极上是氧气发生得电子的还原反应,电解质中的阴离子移向负极;
(5)根据Qc和K之间的关系确定反应的移动方向.
解答:
解:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=206.2kmol-1
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=659.8kJ?mol-1
故答案为:+659.8KJ/mol;
(2)A.升高温度,平衡逆向移动,氢气的转化率减小,故A错误;
B.增加CO2的量,平衡正向移动,氢气的转化率增大,故B正确;
C.充入He,使体系总压强增大,但是各组分浓度不变,平衡不会移动,氢气的转化率不变,故C错误;
D.按原比例再充入CO2和H2,相当于增大压强,所以平衡正向移动,氢气的转化率增大,故D正确.
故选B、D.
(3)氨气具有还原性,次氯酸钠具有氧化性,二者按一定物质的量之比混合反应可生成联氨、氯化钠和水,即2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(4)在燃料点池中,通入氧气的电极右边电极是正极,该极上是氧气发生得电子的还原反应:O2+2H2O+4e-=4OH-,电解质中的阴离子移向负极即左边电极,故答案为:左;O2+2H2O+4e-=4OH-;
(5)在1L的密闭容器中,充入0.2mol SO2、0.1mol O2和1.8mol SO3,此事反应的Qc=
=
=810<1620,所以反应正向移动,故答案为:向正反应进行.
②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=-247.4kJmol-1
据盖斯定律,①×2-②得:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=659.8kJ?mol-1
故答案为:+659.8KJ/mol;
(2)A.升高温度,平衡逆向移动,氢气的转化率减小,故A错误;
B.增加CO2的量,平衡正向移动,氢气的转化率增大,故B正确;
C.充入He,使体系总压强增大,但是各组分浓度不变,平衡不会移动,氢气的转化率不变,故C错误;
D.按原比例再充入CO2和H2,相当于增大压强,所以平衡正向移动,氢气的转化率增大,故D正确.
故选B、D.
(3)氨气具有还原性,次氯酸钠具有氧化性,二者按一定物质的量之比混合反应可生成联氨、氯化钠和水,即2NH3+NaClO=N2H4+NaCl+H2O,故答案为:2NH3+NaClO=N2H4+NaCl+H2O;
(4)在燃料点池中,通入氧气的电极右边电极是正极,该极上是氧气发生得电子的还原反应:O2+2H2O+4e-=4OH-,电解质中的阴离子移向负极即左边电极,故答案为:左;O2+2H2O+4e-=4OH-;
(5)在1L的密闭容器中,充入0.2mol SO2、0.1mol O2和1.8mol SO3,此事反应的Qc=
| c2(SO3) |
| c(O2)?c2(SO2) |
| 1.82 |
| 0.1×0.22 |
点评:本题涉及盖斯定律的应用、化学平衡移动的影响因素、化学反应方向的判断以及原电池的工作原理等知识,属于综合知识的考查,难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
用NA表示阿伏加德罗常数的值.( )
| A、标准状况下,22.4L己烷中共价键数目为19NA |
| B、2.4g镁在空气中充分燃烧所转移的电子总数为0.2NA |
| C、0.1 L1 mol/L的Na2CO3(aq)中CO32-与HCO3-的离子数之和为0.1NA.而1mol NaHSO4熔融产生离子总数3NA |
| D、0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA |
