题目内容
1.化合物K2FeO4可作为一种“绿色高效多功能”水处理剂,可由FeCl3和KClO在强碱条件下反应制得,其反应离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.分析 由FeCl3和KClO在强碱条件下反应制得K2FeO4,发生氧化还原反应,遵循电子、电荷守恒,以此来解答.
解答 解:ClO-有强氧化性,与氯化铁发生氧化还原反应生成高铁酸根离子,由电子、电荷守恒可知离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应中遵循电子守恒,题目难度不大.

练习册系列答案
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
11.糖类是由C、H、O三种元素组成的一类有机化合物.下列物质不属于糖类的是( )
| A. | 葡萄糖 | B. | 淀粉 | ||
| C. | 纤维素 | D. | 味精(主要成分谷氨酸钠) |
9.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1 Na2S溶液中一定有:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 向NH4Cl溶液中加入适量氨水,得到的碱性混合溶液中一定有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 加热Na2S溶液,溶液c(OH-)肯定增大,c(H+)肯定减小 | |
| D. | 加水稀释0.1mol•L-1醋酸溶液,电离平衡向右移动,c(H+)一定减小 |
6.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
| A. | Na+、Fe2+、Cl-、SO42- | B. | Na+、Cl-、CO32-、SO32- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | K+、AlO2-、Cl-、SO42- |
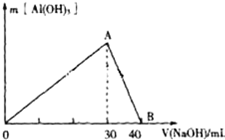 某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:
某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验: