题目内容
10.下列粒子中的原子均达到8电子结构的是( )| A. | BCl3 | B. | CO2 | C. | NH3 | D. | NO2 |
分析 分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断,如果等于8就达到8电子稳定结构,以此解答该题.
解答 解:A.BCl3中B原子最外层电子数为3+3=6,故A不选;
B.CO2中C原子最外层电子数为4+4=8,O的最外层电子数为6+2=8,故B选;
C.NH3中H原子最外层电子数为1+1=2,故C不选;
D.NO2中N原子最外层电子数为5+4=9,故D不选.
故选B.
点评 本题考查原子的结构,为高频考点,侧重考查学生的分析能力,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,难度不大.

练习册系列答案
相关题目
20.FeC13、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断正确的是( )
| A. | 加入KSCN溶液不一定变红色 | B. | 溶液中一定含Cu2+ | ||
| C. | 溶液中一定不含Fe3+ | D. | 剩余固体中一定是Fe |
1.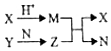 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
 短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中的两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )| A. | 相对分子质量M>N,沸点N>M | B. | 原子半径:D>B>C>A | ||
| C. | Z为Na2CO3 | D. | 图中有两个氧化还原反应 |
18.Q、W、X、Y、Z是原子序数依次增大的短周期元素.X的焰色反应呈黄色.Q元素的原子最外层电子数是其内层电子数的2倍.W、Z元素的原子最外层电子数相同,Z元素的原子的核电荷数是W的2倍.元素Y的合金是日常生活中使用最广泛的金属材料之一.下列说法正确的是( )
| A. | X、Y的最高价氧化物的水化物之间不能发生反应 | |
| B. | W、X两种元素形成的简单离子的半径大小顺序:X>W | |
| C. | 元素Q和Z能形成QZ2型的共价化合物 | |
| D. | Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
15.短周期元素a、b、c、d分属三个周期,且原子序数依次增大.其中b与a、c两种元素均可形成原子个数比为1:1或1:2的化合物,a、c的原子具有相同的最外层电子数,b、d形成的一种化合物在工业上是一种新型自来水消毒剂.下列说法一定正确的是( )
| A. | d的含氧酸是强酸 | |
| B. | 离子半径:d>c>b | |
| C. | b、c、d形成的化合物中只含离子键 | |
| D. | a、c形成的离子化合物具有还原性,可与水反应 |
2.“84消毒液”因1984年北京某医院研制使用而得名,在日常生活中使用广泛,其有效成分是NaClO.某小组在实验室制备NaClO溶液,并进行性质探究和成分测定.
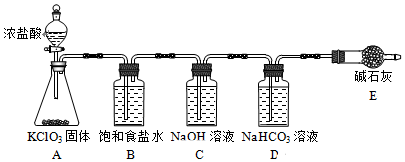
(1)该小组按图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表.(已知饱和NaClO溶液pH为11)
①装置A中反应的化学方程式为KClO3+6HCl=3Cl2↑+KCl+3H2O.
②B瓶溶液中H+的主要来源是氯气中的氯化氢.
③C瓶溶液的溶质是NaClO、NaCl、NaOH(填化学式).
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因溶液中存在平衡Cl2+H2O?HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大.
(2)测定C瓶溶液中NaClO含量(单位:g•L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应.
Ⅱ.用0.1000mol•L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mL Na2S2O3溶液.(I2+2S2O32-═2I-+S4O62-)
①步骤Ⅰ总反应的离子方程式为ClO-+2I-+2H+=I2+Cl-+H2O,盖紧瓶塞并在暗处反应的原因是防止HClO分解.
②C瓶溶液中NaClO的含量为3.7g•L-1.(保留1位小数.NaClO式量为74.5)

(1)该小组按图装置进行实验,反应一段时间后,分别取B、C、D瓶的溶液进行实验,实验现象如表.(已知饱和NaClO溶液pH为11)
| 实验步骤 | 实验现象 | ||
| B瓶 | C瓶 | D瓶 | |
| 实验1:取样,滴加紫色石蕊溶液 | 变红,不褪色 | 变蓝,不褪色 | 立即褪色 |
| 实验2:取样,测定溶液的pH | 3 | 12 | 7 |
②B瓶溶液中H+的主要来源是氯气中的氯化氢.
③C瓶溶液的溶质是NaClO、NaCl、NaOH(填化学式).
④结合平衡移动原理解释D瓶溶液中石蕊立即褪色的原因溶液中存在平衡Cl2+H2O?HCl+HClO,HCO3-消耗H+,使平衡右移,HClO浓度增大.
(2)测定C瓶溶液中NaClO含量(单位:g•L-1)的实验步骤如下:
Ⅰ.取C瓶溶液20mL于锥形瓶,加足量盐酸酸化,迅速加入过量KI溶液,盖紧瓶塞并在暗处充分反应.
Ⅱ.用0.1000mol•L-1 Na2S2O3标准溶液滴定锥形瓶中的溶液,指示剂显示终点时共用去20.00mL Na2S2O3溶液.(I2+2S2O32-═2I-+S4O62-)
①步骤Ⅰ总反应的离子方程式为ClO-+2I-+2H+=I2+Cl-+H2O,盖紧瓶塞并在暗处反应的原因是防止HClO分解.
②C瓶溶液中NaClO的含量为3.7g•L-1.(保留1位小数.NaClO式量为74.5)
9.某l00mL溶液可能含有Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )


| A. | 原溶液一定存在CO32-和SO42-,一定不存在Fe3+ | |
| B. | 是否存在Na+只有通过焰色反应才能确定 | |
| C. | 原溶液一定存在Na+,可能存在Cl- | |
| D. | 若原溶液中不存在Cl-,则c (Na+)=0.lmol•L-1 |
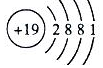

 、
、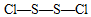 .
.