题目内容
18.铝和镓的性质相似.处理含Ga2O3的Al2O3时,先加入过量NaOH溶液,再通入适量CO2,有Al(OH)3沉淀,而NaGaO2留在溶液中.由此可以判断( )| A. | Ga(OH)3酸性强于Al(OH)3 | B. | Al(OH)3酸性强于Ga(OH)3 | ||
| C. | Ga(OH)3碱性强于Al(OH)3 | D. | Al(OH)3碱性强于Ga(OH)3 |
分析 用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中,说明AlO2-易结合氢离子,则镓酸酸性强于铝酸,由此分析解答.
解答 解:用NaOH溶液处理铝矿(Al2O3)时,生成NaAlO2、NaGaO2;而后通入适量CO2,得Al(OH)3沉淀,而NaGaO2留在溶液中,说明AlO2-易结合氢离子,则镓酸酸性强于铝酸,故选A.
点评 本题考查了同一主族元素性质的递变规律,明确酸的强弱与酸根离子结合氢离子难易之间的关系即可解答,题目难度中等.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
8.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+═Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+═Cu+2Na+ |
| B | 稀盐酸与NaOH溶液反应至中性 H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性 H++OH-═H2O |
| C | 用惰性电极电解NaCl溶液 2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | 用惰性电极电解MgBr2溶液 2Br-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Br2 |
| D | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2 Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
9.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X>M | |
| B. | 将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐 | |
| C. | 由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键 | |
| D. | CaZ、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2 |
6.下列离子方程式书写正确的是( )
| A. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O | |
| C. | Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+ |
3.一定能用离子方程式Ca2++HCO3-+OH-→CaCO3↓+H2O表示的是( )
| A. | 澄清石灰水与少量NaHCO3溶液反应 | |
| B. | 澄清石灰水与过量NaHCO3溶液反应 | |
| C. | Ca(HCO3)2溶液与过量NaOH溶液反应 | |
| D. | 澄清石灰水与过量Ca(HCO3)2溶液反应 |
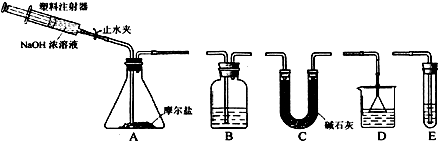
10.下列装置能达到实验目的是( )
| A. | 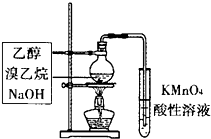 如图检验产物中含有乙烯 | B. | 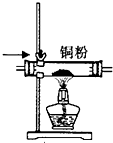 如图除去CO中混有的少量CO2 | ||
| C. | 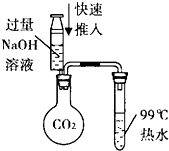 如图验证减压蒸馏原理 | D. | 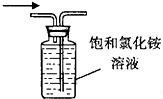 如图收集NH3 |
7.下列叙述正确的是( )
| A. | 凡吸热反应均需在加热条件下才能发生 | |
| B. | 离子化合物中不可能含有共价键 | |
| C. | 液氨作为清洁能源的反应原理是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O | |
| D. | 实验收集NO和乙烯常用排水法不能用排空气法 |
 )是否能使酸性KMnO4溶液褪色,可先将环戊烯溶于适当的溶剂,再慢慢滴入酸性KMnO4溶液并不断振荡.实验中最适合用来溶解环戊烯的试剂是( )
)是否能使酸性KMnO4溶液褪色,可先将环戊烯溶于适当的溶剂,再慢慢滴入酸性KMnO4溶液并不断振荡.实验中最适合用来溶解环戊烯的试剂是( )