题目内容
(1)在标准状况下1.7g氨气所占的体积为 ,它与同条件下 mol H2S含有相同的氢原子数.
(2)某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积是448mL,则氧化物的摩尔质量为 ,R的相对原子质量为 .
(3)在标准状况下,6.72LCH4和CO的混合气体的质量为6g,该混合气体中有 mol的CH4, g的CO.
(4)100mL、0.5mol/L的(NH4)2SO4溶液中含有NH4+ mol,这些NH4+中所含有的电子数为 ,质子数为 .
(2)某气态氧化物化学式为RO2,在标准状况下,1.28g该氧化物的体积是448mL,则氧化物的摩尔质量为
(3)在标准状况下,6.72LCH4和CO的混合气体的质量为6g,该混合气体中有
(4)100mL、0.5mol/L的(NH4)2SO4溶液中含有NH4+
考点:物质的量的相关计算
专题:
分析:根据n=
=
=
=cV结合物质的构成特点计算.
| V |
| Vm |
| m |
| M |
| N |
| NA |
解答:
解:(1)n(NH3)=
=0.1mol,V((NH3)=0.1mol×22.4L/mol=2.24L,n(H)=0.3mol,则n(H2S)=0.15mol,
故答案为:2.24L;0.15;
(2)气体的物质的量为
=0.02mol,该氧化物的摩尔质量为
=64g?mol-1,
又气体的摩尔质量与相对分子质量在数值上相等,R的相对原子质量为64-16×2=32,
故答案为:64g?mol-1;32;
(3)n=
=0.3mol,设CH4为xmol、CO为ymol,
则
,解得x=0.2,y=0.1,m(CO)=0.1mol×28g/mol=2.8g,
故答案为:0.2;2.8;
(4)n((NH4)2SO4)=0.1L×0.5mol/L=0.05mol,
n(NH4+)=0.1mol,
这些NH4+中所含有的电子数为0.1mol×10×NA/mol=NA,
质子数为0.1mol×11×NA/mol=1.1NA,
故答案为:0.1;NA;1.1NA;
| 1.7g |
| 17g/mol |
故答案为:2.24L;0.15;
(2)气体的物质的量为
| 0.448L |
| 22.4L/mol |
| 1.28g |
| 0.02mol |
又气体的摩尔质量与相对分子质量在数值上相等,R的相对原子质量为64-16×2=32,
故答案为:64g?mol-1;32;
(3)n=
| 6.72L |
| 22.4L/mol |
则
|
故答案为:0.2;2.8;
(4)n((NH4)2SO4)=0.1L×0.5mol/L=0.05mol,
n(NH4+)=0.1mol,
这些NH4+中所含有的电子数为0.1mol×10×NA/mol=NA,
质子数为0.1mol×11×NA/mol=1.1NA,
故答案为:0.1;NA;1.1NA;
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下,下列各组离子或分子在指定分散系中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、I-、NO3-、SO42- |
| B、氢氧化铁胶体中:H+、K+、Cl-、S2- |
| C、在pH=0的溶液中:Na+、NH4+、NO3-、Cl- |
| D、水电离产生的c(H+)=1×10-12mol?L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
当光束通过下列分散系时,不能观察到丁达尔效应的是( )
| A、淀粉溶液 |
| B、食盐溶液 |
| C、Fe(OH)3溶液 |
| D、豆浆 |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe2+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生沉淀;过滤、洗涤、灼烧,得到1.6g红棕色固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A、至少存在4种离子 |
| B、Cl-一定存在,且c(Cl-)≥0.4mol/L |
| C、SO42-、NH4+、一定存在,Cl-可能不存在 |
| D、CO32-、Al3+一定不存在,K+可能存在 |
摩尔是( )
| A、计量微观粒子的物质的量的单位 |
| B、表示物质质量的单位 |
| C、国际单位制的一个基本物理量 |
| D、表示6.02×1023个粒子的集体 |
下列有关化学用语错误的是( )
A、Na+的基态电子排布图是: |
B、H2O分子的电子式为: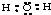 |
| C、Ca2+离子基态电子排布式为:1s22s22p63s23p6 |
D、氯原子结构示意图为: |
 )是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应:
)是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应: