题目内容
常温下,下列各组离子或分子在指定分散系中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、I-、NO3-、SO42- |
| B、氢氧化铁胶体中:H+、K+、Cl-、S2- |
| C、在pH=0的溶液中:Na+、NH4+、NO3-、Cl- |
| D、水电离产生的c(H+)=1×10-12mol?L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
考点:离子共存问题
专题:
分析:A.pH=1的溶液中氢离子浓度为0.1mol/L,硝酸根离子在酸性溶液中具有强氧化性,能够氧化碘离子;
B.氢氧化铁胶粒带有正电荷,能够与阴离子发生聚沉现象;
C.在pH=0的溶液中氢离子浓度为1mol/L,Na+、NH4+、NO3-、Cl-离子之间不发生反应,也不与氢离子反应;
D.水电离产生的c(H+)=1×10-12mol?L-1的溶液中存在电离氢离子或氢氧根离子,碳酸氢根离子、钙离子与氢氧根离子反应,碳酸氢根离子还与氢离子反应.
B.氢氧化铁胶粒带有正电荷,能够与阴离子发生聚沉现象;
C.在pH=0的溶液中氢离子浓度为1mol/L,Na+、NH4+、NO3-、Cl-离子之间不发生反应,也不与氢离子反应;
D.水电离产生的c(H+)=1×10-12mol?L-1的溶液中存在电离氢离子或氢氧根离子,碳酸氢根离子、钙离子与氢氧根离子反应,碳酸氢根离子还与氢离子反应.
解答:
解:A.pH=1的溶液中含有大量氢离子,NO3-离子在酸性溶液中能够氧化I-,在溶液中不能大量共存,故A错误;
B.Cl-、S2-能够与氢氧化铁胶粒发生聚沉现象,在分散系中不能大量共存,故B错误;
C.在pH=0的溶液中氢离子浓度为1mol/L,Na+、NH4+、NO3-、Cl-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.水电离产生的c(H+)=1×10-12mol?L-1的溶液中存在大量H+或OH-,HCO3-、Ca2+、NH4+与氢氧根离子反应,HCO3-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
B.Cl-、S2-能够与氢氧化铁胶粒发生聚沉现象,在分散系中不能大量共存,故B错误;
C.在pH=0的溶液中氢离子浓度为1mol/L,Na+、NH4+、NO3-、Cl-离子之间不反应,且都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.水电离产生的c(H+)=1×10-12mol?L-1的溶液中存在大量H+或OH-,HCO3-、Ca2+、NH4+与氢氧根离子反应,HCO3-与氢离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评:本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
已知反应:2M(g)+N(g)+P(g)
2Q(g)+3R(g)△H>0,在恒容的密闭容器中,下列有关说法正确的是( )
| 催化剂 |
| 180℃ |
| A、平衡时,其他条件不变,增加M的浓度,N的转化率减小 |
| B、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| C、单位时间内消耗N和Q的物质的量比为1:1时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,N和P的转化率增大 |
如图由锌-铜-稀H2SO4组成的原电池装置中,当导线中有0.2mol电子通过时,理论上两极的变化是( )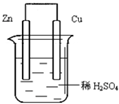

| A、铜片增重6.4g |
| B、锌片增重6.5 g |
| C、铜片上析出0.1 mol O2 |
| D、锌片溶解了6.5 g |
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A、pH=1的溶液中:Na+、K+、MnO4-、C2O42- |
| B、0.1mol/LFeCl3溶液中:Mg2+、NH4+、SCN-、SO42- |
| C、0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl- |
| D、水电离出来的c(H+)=1×10-13mol/L的溶液中:Fe2+、Cu2+、SO42-、NO3- |
下列各组物质中,前者为强电解质,后者为弱电解质的是( )
| A、碳酸氢钠,醋酸 |
| B、食盐,酒精 |
| C、硫酸,硫酸镁 |
| D、碳酸,碳酸钠 |
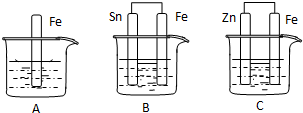 如图所示,烧杯中都盛有稀硫酸.
如图所示,烧杯中都盛有稀硫酸.