题目内容
3.下列分子中,中心原子的杂化轨道类型相同,空间构型也相同的是( )| A. | BeCl2 CO2 | B. | H2O SO2 | C. | BF3 NCl3 | D. | SiCl4 SO3 |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化.
解答 解:A.BeCl2中Be价层电子对个数=$\frac{1}{2}$(2+2)=2,采取 sp杂化方式,分子构型为直线型,O2中C原子价层电子对个数=$\frac{1}{2}$×(4+0)=2,采取sp杂化方式,分子构型为直线型,中心原子的杂化轨道类型相同,空间构型也相同,故A正确;
B.水分子中O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化,分子构型为折线形(V型),SO2中S原子价层电子对个数=$\frac{1}{2}$×(6+0)=3,采取sp2杂化方式,分子构型为V形,二者杂化方式不同,空间构型相同,故B错误;
C.BF3中B原子价层电子对个数=3+$\frac{1}{2}$(3-3×1)=3,中心原子是以sp2杂化,不含孤电子对,所以空间构型是平面三角形,NCl3中N价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,含孤电子对数为1,杂化轨道数4,所以原子杂化方式是sp3杂化,分子形状为三角锥形,二者杂化方式不同,空间构型也不相同,故C错误;
D.SiCl4中C原子价层电子对个数=4+$\frac{4-4×1}{2}$=0,杂化类型为sp3,分子为正四面体形结构,SO3中S价层电子对个数=3+$\frac{1}{2}$(6-3×2)=3,sp2杂化,不含孤电子对,为平面三角形结构,二者杂化方式不同,空间构型也不相同,故D错误;
故选A.
点评 本题考查原子杂化方式判断,为高频考点,明确价层电子对互斥理论即可解答,难点是孤电子对计算方法,题目难度中等.

| A. | 注意节约用水 | B. | 减少食品加工过程 | ||
| C. | 发展氢能和太阳能 | D. | 大量使用化石燃料 |
| A. | 铬元素在周期表中处于第四周期V IB族 | |
| B. | 铬原子的外围电子层排布为3d44s2 | |
| C. | 铬原子中,质子数为24 | |
| D. | 铬元素位于元素周期表的d区,是过渡元素 |
| A. | CH3CH(CH3)CH(C2H5)CH3的系统命名法的名称为2-甲基-3-乙基丁烷 | |
| B. | 乙炔的结构简式为CHCH,乙烯的球棍模型为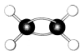 | |
| C. | 己烯和苯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| D. | 向溴乙烷中直接滴加硝酸银溶液,看不到淡黄色沉淀 |
| A. | 俄国化学家门捷列夫于1869年发表了第一张元素周期表 | |
| B. | 现代化学常利用原子光谱的特征谱线来测定分子的结构 | |
| C. | DNA双螺旋的两个螺旋链是用氢键相结合的 | |
| D. | 区分晶体和非晶体最可靠的科学方法是X-射线衍射实验 |
| A. | 铁 | B. | 氯化钙 | C. | 硫酸 | D. | 二氧化碳 |
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电离方程式:HClO=H++ClO- | |
| C. | Na+的结构示意图: | |
| D. | 赤铁矿的主要成分:Fe3O4 |
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO4 | ||
| C. | 白色沉淀是BaSO3、BaSO4的混合物 | D. | FeCl3全部被SO2氧化为FeCl2 |