题目内容
18.现有如下两个反应:(A)NaOH+HCl=NaCl+H2O?(B)2FeCl3+Fe=3FeCl2(1)根据两反应本质,分别判断能否用于设计原电池(A)不行(B)可以.
(2)如果不能,说明其原因(A)不是氧化还原反应,没有发生电子的转移.
(3)如果可以,注明电解质溶液名称和负极材料及其电极反应式.
电解质溶液名称:FeCl3;Fe是负极,负极反应式:Fe-2e-=Fe2+.
分析 (1)原电池反应是自发进行的放热的氧化还原反应;
(2)原电池反应是自发进行的放热的氧化还原反应;
(3)负极发生氧化反应,正极发生还原反应,由此分析解答.
解答 解:(1)原电池反应是自发进行的放热的氧化还原反应,A中各元素化合价不变,不属于氧化还原反应,所以不能设计成原电池,B中Fe元素化合价发生变化,所以可以设计成原电池,故答案为:(A)不行(B)可以;
(2)A不是氧化还原反应,没有发生电子的转移,所以不能设计成原电池,故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)(B)电解质溶液名称FeCl3,活泼的Fe是负极,负极反应式:Fe-2e-=Fe2+,故答案为:FeCl3,Fe,Fe-2e-=Fe2+;
点评 本题考查原电池设计,侧重考查学生知识运用能力明确原电池原理是解本题关键,会根据电池反应式确定正负极及电解质溶液,题目难度不大.

练习册系列答案
相关题目
3.下列分子中,中心原子的杂化轨道类型相同,空间构型也相同的是( )
| A. | BeCl2 CO2 | B. | H2O SO2 | C. | BF3 NCl3 | D. | SiCl4 SO3 |
6.下列叙述正确的是( )
| A. | 甲烷的燃烧热为△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H═2×(-57.3)kJ•mol-1 | |
| C. | Mg在CO2中燃烧生成MgO和C,该反应中化学能全部转化为热能 | |
| D. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 |
3.往50mL FeBr2溶液中缓慢通入1.12L(标况)Cl2溶液中还有$\frac{2}{3}$的Br-未被氧化,则原FeBr2溶液的物质的量的浓度( )
| A. | 3mol/l | B. | 2.4mol/l | C. | 1.2mol/l | D. | 1mol/l |
10.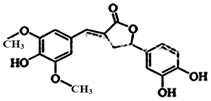 图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )
图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )
 图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )
图示为一种天然产物,具有一定的除草功效,下列有关该化合物的说法正确的是( )| A. | 分子中含有三种官能团 | |
| B. | 1 mol 该化合物最多能与6 mol NaOH 反应 | |
| C. | 既可以发生取代反应,又能够发生加成反应 | |
| D. | 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2 |
7.下列关于有机化合物的叙述正确的是( )
| A. | 聚乙烯塑料的老化是由于发生了加成反应 | |
| B. | (NH4)2SO4浓溶液和CuSO4溶液都能使蛋白质溶液产生沉淀 | |
| C. | 乙烯使溴水褪色与苯使溴水混合振荡后水层变为无色原理相同 | |
| D. | 苯中含有碳碳双键,其性质跟乙烯相似 |
8.下列反应不属于氧化还原反应的是( )
| A. | 2HClO=2HCl+O2↑ | B. | Zn+CuSO4=Cu+ZnSO4 | ||
| C. | 2NaOH+H2SO4=Na2SO4+2H2O | D. | H2+F2=2HF |