题目内容
6.有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用.下列关于硅及其化合物的说法不正确的是( )| A. | 自然界硅元素的贮量丰富,并存在大量的单质硅 | |
| B. | 硅可由二氧化硅还原制得 | |
| C. | 二氧化硅晶体--水晶可用于制造光学仪器等 | |
| D. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 |
分析 A、自然界中没有游离态的硅;
B、二氧化硅与炭在高温条件下反应生成硅和一氧化碳;
C、石英晶体有较好的折光率;
D、玻璃、水泥、陶瓷属于硅酸盐材料;
解答 解:A、硅在自然界中以化合态存在,不存在大量的单质硅,故A错误;
B、二氧化硅与炭在高温条件下反应生成硅和一氧化碳,工业上用此来制备硅,故B正确;
C、石英晶体有较好的折光率,能用于制造光学仪器,所以水晶可用于制造光学仪器,故C正确;
D、常见的硅酸盐材料有玻璃、水泥、陶瓷,故D正确;
故选A.
点评 本题考查了单质硅的性质,注重教材内容的考查,难度不大,可以根据所学知识来回答.

练习册系列答案
相关题目
12.下列反应属于放热反应的是( )
| A. | 稀盐酸与氢氧化钠反应 | B. | 灼热的碳与二氧化碳反应 | ||
| C. | 煅烧石灰石制生石灰 | D. | 氢氧化钡晶体与氯化铵晶体混合 |
17.一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4N02(g)═4NO(g)+C02(g)+2H20(g)△H=-574 kJ.mol-1
②CH4(g)+4NO(g)═2N2(g)+C02(g)+2H2O(g)△H=-1160kJ.mol-1
则下列选项中正确的是( )
①CH4(g)+4N02(g)═4NO(g)+C02(g)+2H20(g)△H=-574 kJ.mol-1
②CH4(g)+4NO(g)═2N2(g)+C02(g)+2H2O(g)△H=-1160kJ.mol-1
则下列选项中正确的是( )
| A. | CH4(g)+2N02(g)═N2(g)+C02(g)+2H2O(l)△H=-867 kJ.mol-1 | |
| B. | CH4催化还原1molNOx为N2的过程中,若x=1.5,则转移的电子总数为3×6.02×1021 | |
| C. | 若0.2 mol CH4还原N02至N2,在上述条件下吸收眵热迸为173.4 kJ | |
| D. | 若用4.48 LCH4还原N02至N2,整个过程中转移电子总数为1.6×6.02×1021 |
1.下列物质属于非电解质的是( )
| A. | NaOH固体 | B. | 氧气 | C. | 乙醇 | D. | Na2CO3溶液 |
18.下列关于化学用语的表示正确的是( )
| A. | 乙醇的结构简式:C2H6O | B. | 丙烷分子的球棍模型示意图: | ||
| C. | 芳香烃的组成通式:CnH2n-6(n≥6) | D. | 乙炔的最简式:CH≡CH |
15.工业上有一种用CO2生产甲醇的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49kJ,现将6molCO2和8molH2充入20L的密闭容器中,测得H2的物质的量随时间变化如图所示,a、b、c、d括号内数据表示坐标.下列说法正确的是( )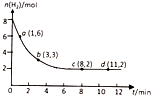

| A. | 升高温度,平衡常数将变大 | B. | 0~1min,v(CO2)=0.1mol/(L•min) | ||
| C. | 达到平衡时,氢气的转化率为75% | D. | 到达平衡时,甲醇的体积分数为20% |