题目内容
15.某化学研究性学习小组拟测定食醋的总酸量(g/10mL),请你参与该小组的实验并回答相关问题.[实验目的]测定食醋的总酸量
[实验原理]中和滴定
[实验用品]蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3,.50g/100mL~5.00g/100mL),0.1000mol/L NaOH标准溶液;100mL容量瓶,10mL移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊).
[实验步骤]
①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中.
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置,读取数据并记录为NaOH标准溶液体积的初读数.
③滴定
往盛有待测食醋溶液的锥形瓶中的滴加某酸碱指示计2~3滴,滴定至终点.记录NaOH的终读数.重复滴定3次.
[数据记录]
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/ml | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)始/ml | 0.00 | 0.20 | 0.10 | 0.10 |
| V(NaOH)终/ml | 14.98 | 15.20 | 15.12 | 16.24 |
(1)步骤①中用煮沸并迅速冷却的方法处理蒸馏水的目的是除去CO2,防止其对实验结果的影响.
(2)步骤③中你选择的酸碱指示剂是酚酞,理由是CH3COONa溶液呈碱性,应选择变色范围在碱性的指示剂.
(3)样品总酸量=4.50g/100mL.
(4)导致实验结果偏大的主要原因是①②(填写序号)
①滴定终点时,仰视滴定管读数
②滴定后滴定管尖嘴处悬有一滴液体
③移液管用蒸馏水洗净后,就用来吸取待测液
④滴定前,碱式滴定管无气泡,滴定后产生气泡
⑤锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水.
分析 (1)根据配制一定物质的量浓度溶液的所需要的仪器来分析;根据蒸馏水中的CO2会影响结果的测定;
(2)根据酸碱反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂;
(3)先分析数据的合理性,求出NaOH体积的平均值,然后根据醋酸与NaOH反应的关系式求出醋酸,最后求出测定食醋的总酸量;
(4)依据滴定实验过程中待测溶液浓度计算分析判断误差,c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$.
解答 解:(1)配制一定物质的量浓度的溶液,用到的仪器有:移液管、洗耳球、烧杯、玻璃棒、胶头滴管以及容量瓶等;蒸馏水要煮沸除去CO2并迅速冷,
故答案为:CO2;
(2)食醋与NaOH反应生成了强碱弱酸盐,溶液呈碱性,应选择碱性变色范围内的指示剂酚酞,
故答案为:酚酞;CH3COONa溶液呈碱性,应选择变色范围在碱性的指示剂;
(3)4次消耗的NaOH溶液的体积为:14.98mL;15.00mL;15.02mL;16.14mL;舍去第4组数据16.14mL,则NaOH溶液的体积的平均值为15.00mL;
设10mL市售白醋样品含有 CH3COOH Xg,则
CH3COOH~NaOH
60 40
Xg×0.2 0.1000mol/L×0.015L×40g/mol
X=0.450
则样品总酸量4.50g/100mL,
故答案为:4.50;
(4)c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,标准溶液浓度、待测溶液体积一定,误差分析取决于标准溶液体积变化,
①滴定终点时,仰视滴定管读数,读取标准溶液体积增大,测定结果偏高,故①正确;
②滴定后滴定管尖嘴处悬有一滴液体,读取标准溶液体积增大,测定结果偏高,故②正确;
③移液管用蒸馏水洗净后,就用来吸取待测液,导致待测液浓度减小,结果偏低,故③错误;
④滴定前,碱式滴定管无气泡,滴定后产生气泡,读出的所用NaOH体积偏小,测定结果偏小,故④错误;
⑤锥形瓶只用蒸馏水洗涤后仍留有少量蒸馏水,对测定结果没有影响.故⑤错误;
故答案为:①②.
点评 本题主要考查了物质组成的测定和含量计算,中和滴定的操作与计算,试题有一定的灵活性,题目难度中等.

| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2═Na2O | |
| B. | 向AgCl悬浊液中滴加NaI溶液,白色沉淀变成黄色AgCl+I-═AgI+Cl- | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| A. | 苯 | B. | 丙烯 | C. | 二甲苯 | D. | 己烷 |
| A. | 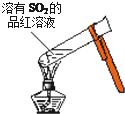 加热后溶液颜色变为无色 | B. |  配制100mL0.10mol•L-1NaCl溶液 | ||
| C. | 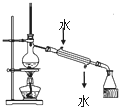 实验室用该装置制取少量蒸馏水 | D. |  称量25gNaOH |
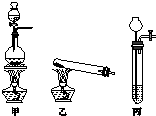 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略). 工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)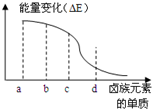 卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
卤族元素的单质(F2、Cl2、Br2、I2)与H2反应过程中的能量变化如右图所示,其中a、b、c、d分别表示卤族中某一元素的单质,△E为相同物质的量的单质与H2反应过程中的能量变化(△E越大,表明反应越容易发生).请回答下列问题:
 .
. .
.