题目内容
10.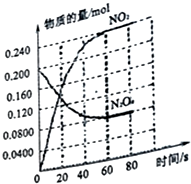 在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:
在容积为2.0L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体颜色变深.回答下列问题:(1)反应的?H>0(填“>”“<”;100℃时,体系中各物质浓度随时间变化如图所示.在0-60s时段,反应速率V (N2O4)为0.0010mol•L-1•s-1.
(2)100℃时达到平衡后,改变反应温度为T1,c(N2O4)以0.00200mol•L-1•s-1的平均速率降低,经10s又达到平衡.计算温度T1时反应的平衡常数K=1.28.(保留三位有效数字).
(3)温度T2时反应达平衡后,将反应容器的容积减少一半,平衡向逆(填“正”或“逆”)反应方向移动.
(4)在温度和体积保持不变的条件下,能够说明该反应达到平衡状态的标志是D.
A.反应混合物各组分物质的量浓度相等
B.N2O4、NO2分子数之比为1:2
C.混合气体的密度保持不变
D.单位时间内消耗1molN2O4的同时,就有2molNO2消耗.
分析 (1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式v=$\frac{△c}{△t}$计算得到;
(2)计算T℃时两种物质的浓度,化学平衡常数利用化学平衡常数表达式计算;
(3)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向;
(4)化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,以此解答.
解答 解:(1)根据图象,N2O4减少,NO2增多,所以N2O4为反应物,NO2为生成物,又反应消耗的浓度之比等于反应物的系数之比,方程式为N2O4═2NO2,随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0,0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=$\frac{0.06mol/L}{60s}$=0.0010mol•L-1•s-1;故答案为:>;0.0010;
(2)平衡时,c(NO2)=0.120mol•L-1+0.0020mol•L-1•s-1×10s×2=0.16mol•L-1,c(N2O4)=0.040mol•L-1-0.0020mol•L-1•s-1×10s=0.020mol•L-1,K2=$\frac{0.1{6}^{2}}{0.020}$=1.28mol/L,
故答案为:1.28;
(3)反应容器的容积减少一半,压强增大,正反应方向气体体积增大,增大压强向着气体体积减小的方向移动,故答案为:逆;
(4)A、反应混合物各组分物质的量浓度不随时间变化而变化时,达到了平衡,但是各组分的浓度不一定相等,故A错误;
B.N2O4、NO2分子数之比为1:2的状态不能说明正逆反应速率相等,不一定平衡,故B错误;
C.混合气体的密度等于气体质量和体积的比值,始终是一个定值,所以密度保持不变的状态不一定是平衡状态,故C错误;
D.单位时间内消耗1molN2O4的同时,就有2molNO2消耗,证明正逆反应速率是相等的,所以达到了平衡状态,故D正确.
故选D.
点评 本题考查化学平衡图象、影响平衡的因素、平衡常数化学反应速率的计算以及平衡状态的判断等,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 正反应速率和逆反应速率都增大,平衡向逆反应方向移动 | |
| B. | 正反应速率和逆反应速率都增大,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
| A. | 碘化钾--加碘盐 | B. | 氧化铝--耐火材料 | ||
| C. | 铁碳合金--碳素钢 | D. | 硅酸盐--普通玻璃 |
| A. | H+、Cl-、NO3-、SiO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、NO3- | D. | NH4+、OH-、Cl-、HCO3- |
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小 | |
| C. | 向水中加入少量固体CH3COONa平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
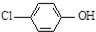 ),其原理如图所示,下列说法正确的是( )
),其原理如图所示,下列说法正确的是( )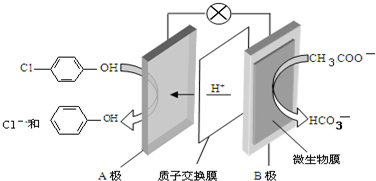
| A. | 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.1NA | |
| B. | A极的电极反应式为 +e-=Cl-+ +e-=Cl-+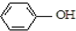 | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
| A. | 单质 | B. | 混合物 | C. | 无机物 | D. | 有机物 |
| A. | 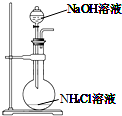 用装置图制取氨气 | B. | 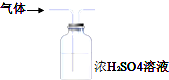 用装置图除去氨气中的水蒸气 | ||
| C. | 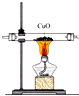 用装置图验证氨气具有还原性 | D. | 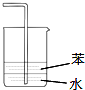 用装置图吸收氨气 |